08届高三化学第一次调研测试试题
化 学
(考试时间100分钟,满分120分,通州中学高三化学备课组命题)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
第Ⅰ卷(选择题 共56分)
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32 Cl-35.5 K—39 Fe—56 As—75 I—127
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确选项符合题意。)
1.正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同;两者互为同分异构体
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
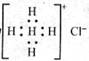 C.SiH4、PH3、HCl的稳定性逐渐增强
C.SiH4、PH3、HCl的稳定性逐渐增强
 D.Ca2+的结构示意图为, NH4Cl的电子式为
D.Ca2+的结构示意图为, NH4Cl的电子式为
2.下列各组物质的分类正确的是
A.强碱:NaOH、CsOH、Ba(OH)2
B.非电解质:C12、NH3、C2H5OH
C.碱性氧化物:MgO、Mn2O7、NaO
![]() D.同系物:
D.同系物:
3.类推的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论,因此类推出的结论最终要经过实践的检验才能确定是否正确。以下几种类推结论中正确的是
A.CaCO3的溶解度小于Ca(HCO3)2,推出Na2CO3溶解度小于NaHCO3
B.NH3的沸点高于PH3,推出CH4沸点高于SiH4
C.H2SO4为强酸,推出HClO4为强酸
D.碳的+4价化合物稳定,推出铅的+4价化合物稳定
4、下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是:①碳酸钠溶液与盐酸;②偏铝酸钠溶液与盐酸;③苯酚钠溶液和CO2;④硝酸银溶液和氨水;⑤氯化铝溶液与氨水;⑥碳酸氢钠溶液与澄清的石灰水。
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
5、已知S2O![]() 离子和H2O2一样含过氧键,因此也有强氧化性, S2O
离子和H2O2一样含过氧键,因此也有强氧化性, S2O![]() 离子在一定条件下可把Mn2+氧化成MnO
离子在一定条件下可把Mn2+氧化成MnO![]() 离子,若反应后S2O
离子,若反应后S2O![]() 离子变成SO
离子变成SO![]() 离子;又知反应中氧化剂与还原剂的离子数之比为5:2则S2O
离子;又知反应中氧化剂与还原剂的离子数之比为5:2则S2O![]() 中的n值和S的化合价是
中的n值和S的化合价是
A. 2, +7 B. 2, +6 C.4 ,+7 D. 4 , +4
6.某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):(a)KI溶液;(b)淀粉溶液;(c)NaOH溶液;(d)稀H2SO4溶液;(e)氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。依据溶液颜色的变化,加入以上药品的顺序是
A.a→b→e→c→d B.a→e→b→c→d
C.b→e→a→d→c D.a→d→b→e→c
7.应用纳米新材料能给人民币进行杀菌、消毒。我国纳米专家王雪平发明的“WXP复合纳米材料”主要化学成份是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用。鉴于此,35位人大代表联名提交了一份议案,要求加快将此新技术应用到人民币制造中去。有若戊二醛是直链的,请你根据所学的知识推断沸点不同的氨基二氯代戊二醛的同分异构体可能有
A.4种 B.5 种 C.6种 D.8种
8.甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
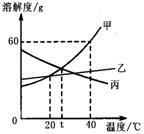 A.40℃时,100g水中最多溶解甲60g
A.40℃时,100g水中最多溶解甲60g
B.t℃时,甲与丙的溶解度相等
C.分别将40℃时甲、丙的饱和溶液降温至t℃,
所得两溶液中溶质的质量分数相等
D.甲中混有少量乙,可用降温结晶法分离提纯甲
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分)
9.依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
A.依据元素的原子序数,推断该元素原子的核外电子数
B.依据物质相对分子质量,推断物质熔、沸点的高低
C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小
D.依据金属离子所带正电荷的多少,推断其氧化性的强弱
10.NA代表阿伏加德罗常数值,下列说法正确的是
A.32gCu与足量的硫蒸汽充分反应,电子转移总数为1.0 NA
B.1.4 g乙烯和丙烯的混合物中含碳原子数为0.l NA
C.6.4gCaC2晶体中含有0.1 NA个阴离子
D.2.24L(标准状况)Cl2与足量NaOH溶液在常温下反应.转移的电子数为0.2 NA
11.常温下为气态的饱和链烃(碳原子数![]() 4)两两混合,若取混合物37g与O2完全反应生成CO2,消耗氧气4.25mol。则此混合物的可能组合的方式最多有
4)两两混合,若取混合物37g与O2完全反应生成CO2,消耗氧气4.25mol。则此混合物的可能组合的方式最多有
A.3种 B.4种 C.5种 D.6种
12. X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是
A.原子半径的大小顺序:Y>Z>X
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物对应的水化物不能互相反应
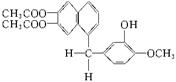 13.鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如右:
13.鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如右:
1mol该化合物完全燃烧耗O2的物质的量、与NaOH溶液作
用消耗NaOH的物质的量、其苯环上的一溴代物的种数分别是
A.26 mol、4 mol、7 B.24 mol、4 mol、8
C.26 mol、5 mol、7 D.24 mol、5 mol、8
14.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH—
+O2+xOH—
Fe3O4+S4O![]() +2H2O,下列说法中,正确的是
+2H2O,下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol
B.Fe2+和S2O![]() 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=2
15.下列离子方程式正确的是
A.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7
Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 2Fe2+ + 2H+ + H2O2 =2 Fe3+ + 2H2O
D.向NaHCO3 溶液中加入过量Ca(OH)2 溶液
2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32-
16、将相等物质的量的硫酸铝和硫酸铵溶于水形成V mL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是
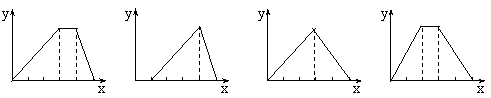 |
A B C D
第Ⅱ卷(非选择题 共64分)
三、(本题包括2小题,共18分。)
17.(10分)我国中医药已有数千年历史,其独特的疗效使得经深加工的中药产品正逐步进入国际市场,但国外在进口中药时对中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素砷的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的砷元素将转化为H3AsO3;
②将待测溶液转移入250mL锥形瓶中,并加入2-3滴0.2%的淀粉溶液;
③用标准碘溶液滴定待测溶液至终点,消耗20.25mL标准I2溶液,其中发生反应:
H3AsO3+ I2+ H2O→H3AsO4+ I-+ H+(未配平)
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
▲
(2)配平离子反应方程式:__H3AsO3+__I2+__H2O— __H3AsO4+__I-+__H+
(3)0.2%的淀粉溶液的作用是 ▲ ,如何判断滴定到达终点? ▲ 。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程 ▲ 。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试计算说明该中草药样品是否合格?(不需计算过程)计算可知该样品砷含量约为 ▲ mg/kg,故该草药样品 ▲ (填“合格”或“不合格”)。
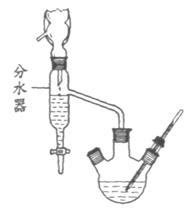 18.(8分)已知苯甲酸乙酯的沸点为213℃,水-乙醇-环己烷三元共沸物的共沸点为62.1℃(即在此温度下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出)。请回答就下述实验室制备苯甲酸乙酯提出的问题:
18.(8分)已知苯甲酸乙酯的沸点为213℃,水-乙醇-环己烷三元共沸物的共沸点为62.1℃(即在此温度下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出)。请回答就下述实验室制备苯甲酸乙酯提出的问题:
(1) ①在圆底烧瓶中加入苯甲酸、浓硫酸、过量的乙醇、沸石;②再向烧瓶中加入环己烷,装上分水器和回流冷凝管,这一步的实验目的是 ▲ 。
(2) 缓慢加热回流,至分水器下层液体不再增多,停止加热;放出分水器中液体,水器中液体的三种主要成分是 ▲ ;继续加热,使多余的乙醇、环己烷蒸至分水器中;至分水器液体不再增加,停止加热。
(3) 将圆底烧瓶中残液倒入盛有冷水的烧杯中,用 ▲ 溶液中和至弱碱性;分液,分出粗产品;水层用乙醚 ▲ (填实验操作名称),醚层与粗产品合并;用纯水洗有机层2次,将醚层与水尽量分净,醚层从上口倒入一个干燥的锥形瓶。
(4) 加入适量豆粒大小的无水氯化钙干燥剂,摇动锥形瓶,至醚层澄清透明;醚层过滤入一个干燥的圆底烧瓶;进行 ▲ (填实验操作名称),先蒸出 ▲ ,后蒸出苯甲酸乙酯。
四、(本题包括2小题,共16分。)
19.(10分)在周期表中同一主族元素的化学性质相似,但也发现有些元素的化学性质和它在周期表里的左上方或右下方的另一主族元素相似,被称为对角线法则,示意图如下:
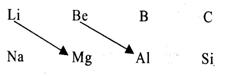 请据图回答下列问题:
请据图回答下列问题:
(1)B的原子结构示意图为 ▲ ,B元素
位于元素周期表的 ▲ 周期 ▲ 族。
(2)铍的最高价氧化物的水化物是 ▲ 化合物(填“酸性”、“碱性”或“两性”),证明这一结论的有关离子方程式是 ▲ 。
(3)根据周期律知识,硼酸的酸性比碳酸 ▲ ,理由 ▲ 。
(4)根据Mg在空气中的燃烧情况,Li 在空气中燃烧生成产物为 ▲ (用化学式表示)。
20.(6分)不同卤素原子间可以通过共用电子对,形成卤素互化物,其通式为:XX′n (n = 1,3,5,7;且非金属性X′>X)。卤素互化物大多为强氧化剂。回答下列问题:
(1)卤素互化物中,沸点最低的应是 ▲ (写分子式,下同)。
(2)若n = 7,则最可能生成的卤素互化物应为 ▲ 。
(3)某卤素互化物与水的反应为 ClFn + H2O → HClO3 + Cl2 +O2 + HF,若ClFn与H2O的物质的量之比为3∶5,则n的值为 ▲ 。
五、(本题包括2小题,共18分)
21.(10分)石油资源紧张曾是制约我国轿车业发展,尤其是制约轿车进入家庭的重要因素。据2001年5月28日某媒体报道,中国宣布将推广“车用乙醇汽油”。所谓乙醇汽油就是在汽油中加入适量乙醇混合而成的一种燃料。
(1)汽油是由石油分馏和裂化所得的低沸点烃,其分子中的碳原子数一般在5~11的范围内。如戊烷,其分子式为C5H12,试写出它的一氯代物只有一种结构的某同分异构体的结构简式 ▲ 。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。请写出乙醇不完全燃烧生成CO2、CO、H2O(其中生成的CO2与CO的质量比为11∶14)的化学反应方程式 ▲ 。
(3)某种天然高分子化合物X在酶的作用下可生成一种化合物Y,Y在另一种酶的作用下可生成乙醇,试写出Y的结构简式 ▲ ,并根据Y的结构特点指出它可能发生的化学反应 ▲ (填反应类型)。
(4)工业上还可以用石油裂解的重要产品——乙烯来制取乙醇,请写出由乙烯制乙醇的化学反应方程式 ▲ 。
(5)车用乙醇汽油称为环保燃料,其原因是 ▲ 。
22.(8分)已知①两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:
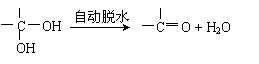 |
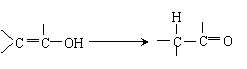 ② 羟基与烯碳原子相连时,它的结构也是不稳定的,易发生下列转化:
② 羟基与烯碳原子相连时,它的结构也是不稳定的,易发生下列转化:
 |
现有分子式为C9H8O2Br2的物质M,可在一定条件下发生下述一系列反应:
请回答下列问题:
⑴G→H的反应类型是 ▲ 。
⑵M的结构简式为 ▲ ;N的结构简式为 ▲ 。
⑶写出下列反应的化学方程式:
①A→ B的化学方程式 ▲ ;
②H→I的化学方程式 ▲ 。
六、(本题包括2小题,共12分。)
23.(6分)
|
(1)写出相关的反应的离子方程式。
▲
(2)原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为多少?
▲
24.(6分)400K、1.01×105 Pa时,2 L烃A的蒸气能在V L氧气中完全燃烧,反应后体积增至(V+4) L(体积在同前的条件下测定)。请回答:
(1) 烃A在组成上应满足的条件是 ▲ 。
(2) 当V=15时,该烃可能的分子式为 ▲ 。
(3) 若A在常温常压下为气态,V的取值范围是 ▲ 。
化学试卷参考答案及评分标准
一、选择题(每小题有1个正确选项,每小题3分,共24分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | A | C | A | A | B | D | C |
二、选择题(每小题有1~2个正确选项,每小题4分,共32分)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| BD | BC | B | AC | D | AB | C | A |
三、(本题包括2小题,共18分)
17.(10分)
(1)取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液(2分)。
(2)1,1,1,1,2,2 (2分)。
(3)作为指示剂以判断滴定的终点(1分);溶液由蓝色变为无色,保持半分钟不变色 (1分)。
(4)IO3-+5I-+6H+=3I2+3H2O(2分)。
(5)在2.278mg/kg到2.279mg/kg范围内均可得分(1分); 不合格(1分)。
18.(8分)
(1)通过形成水-乙醇-环己烷三元共沸物分离反应过程中生成的水,促进酯化反应向正方向进行 (2分)
(2)水、乙醇、环己烷(少写一种即不得分) (2分)
(3) Na2CO3 萃取 (2分)
(4)蒸馏 乙醚 (2分)
四、(本题包括2小题,共16分)
 19.(10分)
19.(10分)
(1) +5 2 3;
第二 第ⅢA (2分)
(2) 两性; Be(OH) 2+2OH-→BeO22-+2H2O;Be(OH) 2+2H+→Be2++2H2O;(4分)
(3) 弱,硼的非金属性比碳弱 (2分)
(4) Li2O,Li3N (2分)
20 (6分)
⑴ClF(2分) ⑵IF7(2分) ⑶ n = 3(2分)
五、(本题包括2小题,共18分)
21.(8分)
(1)(CH3)4C (1分)
(2)3CH3CH2OH+7O2 ![]() 2CO2+4CO+9H2O (2分)
2CO2+4CO+9H2O (2分)
(3)CH2OH(CHOH)4CHO (2分)
氧化、加成(还原)与酯化反应(共2分,写对两种即给2分,对1个给1分,有错不给分)
![]() (4)CH2=CH2+H2O
CH3CH2OH
(2分)
(4)CH2=CH2+H2O
CH3CH2OH
(2分)
(5)能有效降低汽车尾气带来的严重大气污染,改善环境质量 (1分)
22.(10分)
(1)加成反应 (还原反应) (2分)
![]() (2)Br2CH— —OOCCH3 CH3COOCH=CH2 (4分)
(2)Br2CH— —OOCCH3 CH3COOCH=CH2 (4分)
|
②
(4分)
六、(本题包括2小题,共12分)
23: (6分)
(1)4H++NO3-+Fe= Fe3++NO↑+2H2O 2Fe3++ Fe=3Fe2+ (4分)
(2) 4:1 (2分)
24:(6分)烃分子中氢原子数为8;C3H8、C4H8、C5H8; ≥12(每空2分,共6分)。
解析:
(1)应用公式计算氢原子数。2(y/4-1)=2,y=8。即烃中氢原子数应为8。
(2)可能出现的烃及耗氧量是:C3H8 5×2=10;C4H8 6×2=12;C5H8 7×2=14;C6H8 8×2=16>15。故可能的分子式为:C3H8、C4H8、C5H8。
(3)A在常温常压下为气态,可能为C3H8、C4H8,二者都要满足,故V 应不小于12。