08届高三化学第三次月考试题
可能用的相对原子质量:O—16 Na—23 S—32 Fe—56
一、选择题(本大题共8小题,每小题6分,共48分,在每小题给出的四个选项中,只有一项是符合题目要求的)
1.用NAmol-1表示阿伏加德罗常数。下列说法中正确的是 ( )
A.Cl2摩尔质量与NA个Cl2分子的质量在数值上相等
B.23gNa与足量水反应转移电子数为2NA
C.2.24LCO2中含有的原子数为0.3NA个
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
2.下列叙述中不正确的是 ( )
A.用明矾净化饮用水与胶体有关
B.C(石墨s)=C(金刚石,s) △H>0,所以石墨比金刚石稳定
C.![]() 和
和![]() 互为同位素,性质相似
互为同位素,性质相似
D.使用太阳能,风能等能源替代传统煤炭既可以降低污染,又可以减少能源危机
3.下列叙述中不正确的是 ( )
A.阳离子不一定是金属离子,含有阳离子的物质一定含阴离子
B.阴、阳离子相互作用不一定形成离子化合物
C.分子晶体中一定含有范德瓦尔斯力,含有范德瓦尔斯力的晶体不一定是分子晶体
D.金属晶体的熔点和沸点一般都很高
4.相同温度浓度为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,测得其c(NH4+)分别为a、b、c(单位mol·L-1)。下列判断正确的是: ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
5.下列反应①碳酸氢钙与NaOH溶液反应②苯酚钠溶液与二氧化碳反应③氯气与烧碱稀溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是与石灰水反应 ( )
A.①② B.①③ C.①④ D.②④
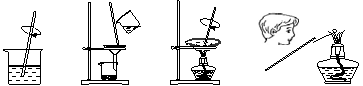 6.由草木灰提取钾盐并检验钾元素存在的下列实验操作中,错误的是 ( )
6.由草木灰提取钾盐并检验钾元素存在的下列实验操作中,错误的是 ( )
A.溶解 B.过滤 C.蒸发 D.焰色反应
7.某pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈碱性,其原因可能是: ( )
A.稀的强酸溶液和浓的强碱溶液反应 B.浓的弱碱溶液和稀的强酸溶液反应
C.等浓度的强碱和弱酸溶液反应 D.一元强酸溶液和二元强碱溶液反应
8.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中15molCuSO4氧化的P原子的物质的量为 ( )
A.3mol B.11mol C.6mol D.5mol
二、非选择题(4小题,共60分)
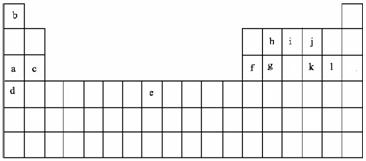
9.(14分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
 |
回答下列问题
⑴以上元素中原子半径最大的是 (填写元素符号)最小的是 (填写
元素名称)
⑵以上元素中,属于金属的:①在地壳中含量最高的是 ,(填写字母代号)②
单质的工业年产量最高的是 (填写周期表中的具体位置)
⑶h和g的最高价氧化物比较,熔点高的是 (填写氧化物化学式);j和
k的氢化物比较,熔点高的是 (填写氢化物化学式)
⑷以上元素两两形成的中学中常见的化合物中①既有离子键,又有非极性共价键的有
(写一种)(填写化学式)
⑸按要求写①c的氧化物与l的氢化物反应的化学方程式
②都是由abjk四种元素形成的两种化合物反应的离子方程式
⑹bil三元素形成的化合物的电子式为
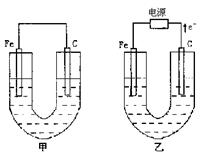
10.(15分)甲、乙两池电极材料如图所示,请按要求回答下列问题:
 | |||
| |||
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后
①有红色物质析出的是甲池中的________棒(铁、炭);乙池中的_____极(阴、阳)。
②乙池中阳极上发生的电极反应方程式是_________________。
(2)若两池中均为饱和NaCl溶液
①写出乙池中总反应的化学方程式_________________________。
②甲池中碳极上电极反应方程式是_________________,乙池碳极上电极反应属于___________(填氧化反应、还原反应)。
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的![]() 又氧化。若反应的
又氧化。若反应的![]() 和
和![]() 物质的量之比为5:1,且生成HCl和另一种强酸,该强酸的化学式为_______________。
物质的量之比为5:1,且生成HCl和另一种强酸,该强酸的化学式为_______________。
④若乙池转移0.1mol![]() 后停止实验,池中溶液体积是1L,则溶液混匀后的pH=___。(不考虑所生成的气体溶解在溶液中的情况)
后停止实验,池中溶液体积是1L,则溶液混匀后的pH=___。(不考虑所生成的气体溶解在溶液中的情况)
11.(16分)某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
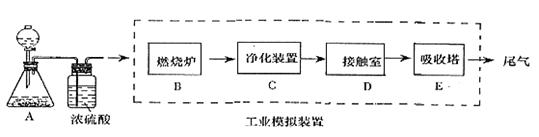 |
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ,在该反应中____________做氧化剂,若消耗了12gFeS2有_________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是___________________________________;
(4)如果D装置的温度是400℃~500℃,回答在工业中不采取加压措施的原因_______
______________________________________ ;
(5)为检验从接触室出来的气体成分,甲同学设计如下实验:
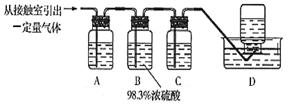
①A中盛放的试剂是____________________;
②B中盛放98.3%浓硫酸的作用是_______________________________________,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案
_ _____(填“可行”或“不可行”)说明理由___________ ;
③C中盛放的试剂是________________,其作用是 。
12.(15分)为了测定某种含有Na2O杂质的Na2O2试样的纯度,3个课外活动小组分别设计了如下三个实验方案。首先准确称量出要进行反应的样品的质量m g,然后,将按照以下方案进行实验:
方案一:将样品与水充分反应,使产生的气体与加热的铜粉充分反应,测定反应后生成的氧化铜的质量为n g,通过计算求出试样中的含量。
(1)按照此方案,则试样中Na2O2的含量为 (用含 m、n的式子表示)
a(Na2O2)% ==![]()
(2)此方案测定的结果误差较大,主要原因是:
方案二:将样品与实验生成的二氧化碳反应,通过测定反应产生的气体的体积,计算求出试样中Na2O2的含量。
(1)按照此方案,以下制取二氧化碳和进行反应使用的仪器的连接次序是
(填写仪器的编号)
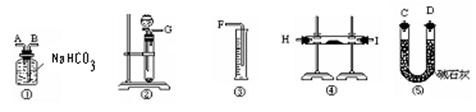 |
(2)通过①仪器的气体从流向上看,次序为 进 出(填写导管的字母)
 方案三:将样品与水充分反应,测定出反应后的溶液的准确体积VL,因为体积较大,再从反应后的溶液中,取一定的准确的体积为V1ml溶液,装入锥形瓶中,用标准浓度的盐酸进行滴定,测定出样品与水反应后所得到的溶液的浓度,再计算求出试样中Na2O2的含量。
方案三:将样品与水充分反应,测定出反应后的溶液的准确体积VL,因为体积较大,再从反应后的溶液中,取一定的准确的体积为V1ml溶液,装入锥形瓶中,用标准浓度的盐酸进行滴定,测定出样品与水反应后所得到的溶液的浓度,再计算求出试样中Na2O2的含量。
(1)按照此方案,进行酸碱中和滴定时,最后一步操作应该选择
的下列仪器中的 (填写仪器的编号)
(2)选择甲基橙做指示剂,确定终点的现象应该是溶液颜色由
变 并且半分钟内不变
你认为方案二、方案三中测定结果最准的是
 |
参考答案
一、选择题(本大题共8小题,每小题6分,共48分,在每小题给出的四个选项中,只有
|
1.A 2.C 3.D 4.D 5.C 6.D 7.B 8.A
二、非选择题(60分)
9.(14分) ⑴ K ;(1分)氢 (1分)
⑵ ①f ;(1分)②第四周期,第Ⅷ族 (1分)
⑶ SiO2; (1分) H2O(1分);
⑷ Na2O2 (2分)(或FeS2;Na2SX等等,填写任意一个正确的即可);
⑸ ①MgO + 2HCl == MgCl2 + H2O (2分) ② H++ HSO-3 == SO2#+ H2O (2分)
⑹ ![]() (2分)
(2分)
10.(15分)(1)①炭 (1分) 阴(1分) ②![]() (2分)
(2分)
(2)①![]() (2分)
(2分)
②![]() (2分)
氧化反应(2分)
(2分)
氧化反应(2分)
③HIO3 (2分) ④13 (3分)
11.(16分)
(1)2H2O2![]() 2H2O
+O2↑(或2 Na2O2+ 2H2O
2H2O
+O2↑(或2 Na2O2+ 2H2O![]() 4NaOH+O2↑) (2分)
4NaOH+O2↑) (2分)
(2)4FeS2+11O2![]() 2Fe2O3+8SO2↑(2分) 氧气(1分) 1.1mol(1分)
2Fe2O3+8SO2↑(2分) 氧气(1分) 1.1mol(1分)
(3)催化剂中毒(1分) (4)在常压下400℃~500℃时,SO2的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。(2分)
(5)①氯化钡溶液(1分) ②除去SO3,排除SO3对SO2检验的干扰(1分) 不可行(1分) 虽然饱和NaHSO3溶液可除去SO3,但SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验。(2分) ③品红溶液(或溴水) (1分) 检验SO2 (1分)
12.(15分)
方案一:
(1) a(Na2O2)% ==![]() (3分)
(3分)
(2) 主要原因是:气体在与固体反应时,必须过量才有可能将固体全部反应完。(或铜粉不一定全部都变成了氧化铜等等,其他的合理答案都可以)(2分)
方案二:
(1) 仪器的连接次序是 ②④⑤①③ (2分) [说明:②是制取二氧化碳④是装置发生主要反应⑤除去HCl、CO2对后面实验的干扰①排NaHCO3法测定气体体积测定液体(实质是气体)的体积]
(2) ① A 进 B 出 (2分)
方案三:
(1) 应该选择的仪器是 ①⑤ (2分)
(2) 溶液颜色由 黄 变 橙(或红) (2分)
最准确的是 : 方案三 (2分)