08届高三化学第二次模拟考试
化 学 试 卷
一、选择题(共15小题,每题只有1个正确答案,每小题3分)
1.金属铜的提炼多从黄铜矿开始。黄铜矿在燃烧过程中主要反应之一的化学方程式为:
2CuFeS2+O2=====Cu2S+2FeS+SO2,下列说法不正确的是
A.O2只做氧化剂 B.CuFeS2既是氧化剂又是还原剂
C.SO2既是氧化产物又是还原产物 D.若有1molO2参加反应,则有4mol电子转移
2.4℃时,25滴水为amL,则1滴水中含有的水分子数为
A.aNA/25 B.aNA/(25×18) C.aNA/(25×20) D.aNA/(1000×22.4)
3.下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
4.NO3-+Zn+OH-+H2O→NH3+Zn(OH)42-配平后,离子方程式中H2O的化学计量数
A.2 B.4 C.6 D.8
5.已知热化学方程2KNO3(s)====2KNO2(s)+O2(g);△H=+58kJ/mol;C(s)+O2(g)===CO2(g);△H=-94kJ/mol。为提供分解1molKNO3所需能量理论上需燃烧碳为
A.58/94mol B.58/(94×2)mol
C.(58×2)/94mol D.(94×2)/58mol
6.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下其充分反应后的固体,经测定Na2O2无剩余,则最后的固体的物质的量为
A.1~4mol B.1~2mol C.2~4mol D.大于4mol
7.下列各组物质相互反应时,能产生可燃性气体的是
①炭块投入热的浓硝酸中 ②铁丝投入稀硫酸中
③过氧化钠投入水中 ④电石投入食盐水中
A.①③ B.②③④ C.①④ D.②④
8.向前者的溶液中逐滴加入后者的溶液,不能看到先浑浊后澄清现象的是
A.苯酚钠溶液、稀硫酸 B.AlCl3溶液、NaOH溶液
C.Fe(OH)3溶胶、稀硫酸 D.NaAlO2溶液、稀盐酸
9.对于Br2+2H2O+SO2=====2HBr+H2SO4和2HBr+H2SO4(浓)====Br2+2H2O+SO2↑的判断正确的是
A.它们互为可逆反应
B.反应条件的改变,引起了反应方向的改变,都符合事实
C.氧化性H2SO4>Br2,还原性Br2>H2SO4
D.它们互相矛盾,不符合事实
10.下列各项中的两个量,其比值一定为2:1的是
A.在反应2FeCl3+Fe====3FeCl2中还原产物与氧化产物的质量
B.在相同温度下,0.2mol·L-1CH3COOH溶液与0.1mol·L-1CH3COOH 溶液中c(H+)
C.在密闭容器中,N2+3H2![]() 2NH3已达到平衡c(NH3)和c(N2)
2NH3已达到平衡c(NH3)和c(N2)
D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液体积
11.下列各组物质用水就可以鉴别的是
①固体:NaCl NaOH NH4NO3 ②液体:苯 酒精 四氯化碳
③气体:H2 N2 SO2
A.①③ B.②③ C.①② D.①②③
12.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中电离过程为:
OH OH
| |
HO—B+H2O ![]() [HO—B—OH]-+H+
[HO—B—OH]-+H+
| |
OH OH
下列判断正确的是
A.凡是酸或碱对水的电离都是抑制的 B.硼酸是三元酸
C.硼酸溶液与NaOH溶液反应的离子方程式:H3BO3+OH-====[B(OH)4]-
D.硼酸是两性化合物
13.用即热饭盒盛装食物,可以得到热烘烘的饭菜。原因是即热饭盒的底部装入混有镁、铁粉末的高密度聚乙烯,进行简单的操作后水和镁就会发生剧烈的化学反应,放出热量便可使食物变热,其中铁可能是
A.一种反应物 B.催化剂 C.起导热作用
D.增大镁与水分子的接触机会
14.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;
③氢化物常温下都是气态,所以又都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确 C.只有③④正确 D.①②③④均不正确
15.已知CuSO4溶液分别与Na2CO3溶液,Na2S溶液的反应情况如下:
(1)CuSO4溶液和Na2CO3溶液
主要:Cu2++CO32-+H2O=====Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=====CuCO3↓
(2)CuSO4溶液和Na2S溶液
主要:Cu2++S2-====CuS↓
次要:Cu2++S2-+H2O====Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3 B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2>CuCO3>CuS
芜湖一中2008届高三第二次模拟考试
化 学 答 题 卷
一、选择题(共15小题,每题只有1个正确答案,每小题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
二、实验题(共15分)
16.(5分)下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是 (填写编号)
(2)由于操作错误,使得到的数据比正确数据偏小的是 (填写编号)
A.实验室制乙烯测量混合液温度时,温度计的水银球与烧瓶底部接触
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
17.(10分)
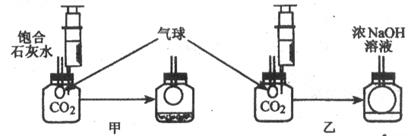
【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
【实验探究】在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液。
实验装置和现象如图所示。请你一起参与。
|
【现象结论】甲装置中产生该实验现象的化学方程式为 。
解释通常用石灰水而不用NaOH溶液检验CO2的原因
;乙装置中的实验现象是 。
吸收CO2较多的装置是 。
【计算验证】另一位同学小李通过计算发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH。因此,他认为通过吸收CO2应该用饱和石灰水。
【思考评价】请你对小李同学的结论进行评价:
。
三、填空题(28分)
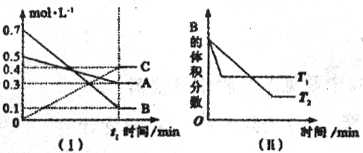 18.(9分)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。
18.(9分)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为 ,正反应为
(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆方向移动的有
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.其他条件不变,升高湿度
(3)T℃时,在相同容积的1L容器中,起始充入amolA,bmolB和0.2molC于容器中,达到平衡后B的体积分数与t1时B的体积分数相同。则a= ,b= 。
19.(10分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知:
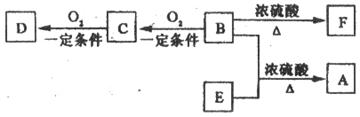
①B分子中没有支链
②D能与碳酸氢钠溶液反应放出二氧化碳
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式: 、
、 、 。(可不填满,也可补充)
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是:
。
20.(9分)如图所示接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
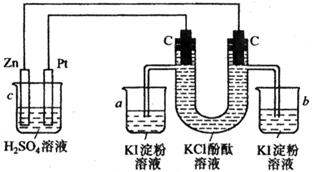
(1)U型管可观察到 ,写出有关反应的化学方程式 。
(2)在小烧杯a、b中分别有什么现象产生 。
(3)如果小烧杯中有0.508g碘析出,问烧杯C中负极的质量减轻 克
四、计算题(12分)
21.(4分)测知某CaO和CaCO3组成的混合物中钙元素的质量分数为50%,取此混合物4g,高温煅烧至质量不再改变为止,冷却;在t℃时,把剩余固体全部加入50.9g水中,充分搅拌后,过滤,干燥得白色固体3.61g。求:
(1)4g混合物高温煅烧后的质量。
(2)t℃时Ca(OH)2的溶解度。
22.粉末试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L 6.0mol/L盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标准状态)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填写:
(1)产物中的单质B是 ;
(2)③中所发生的各反应的离子方程式是 ;
(3)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为 ,
C(Fe2+) 。
08届高三第二次模拟考试
化 学 参 考 答 案
一、选择题(共15小题,每题只有1个正确答案,每小题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | B | C | C | B | A | D | A | B | A | C | C | B | D | A |
二、实验题(共15分)
16.(1)a、b、c (2)B (3)9.5g
17.(10分 每空2分)
CO2+Ca(OH)2=CaCO3↓+H2O(CO2适量)CO2和石灰水作用有明显的现象,和NaOH作用无明显现象; 气球体积增大,溶液不变浑浊。 乙 因为Ca(OH)2的溶解度较小,所形成的饱和石灰水中溶质的质量分数很小。
三、填空题(28分)
18.(9分)(1)A(g)+3B(g)![]() 2C(g) 放热(2)C(3)0.4(4)0.4
2C(g) 放热(2)C(3)0.4(4)0.4
19.(10分)(1)①②④ (2)羧基 碳碳双键
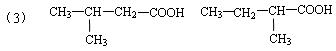
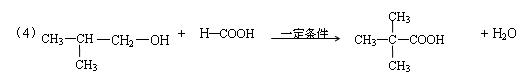
20.(8分)(1)两极上均有气体产生,U型管右边酚酞溶液变红,气体分别导入到a、b两只小烧杯中。
2KCl + 2H2O![]() 2KOH + H2↑+ Cl2↑
2KOH + H2↑+ Cl2↑
(2)a烧杯中有气泡,溶液显蓝色,b烧杯中有气泡,溶液颜色不变。
(3)0.13克
四、计算题(13分)
21.(6分)(1)2.8克(2)0.18克
22.(7分)(1)Fe (2)Fe +2HCl=Fe Cl2+H2↑ Fe +2Fe3+ =3Fe2+
(3)0.67mol/L 2.33mol/L