08届高三化学纠错再练试题一
2008-4-14
1.下列物质属于电解质的是
①硫酸 ②甲酸③蔗糖 ④ Cu ⑤ NH3 ⑥ CaCO3 ⑦ 熔化的KCl ⑧KCl溶液
A、① ② ⑤ ⑥ ⑦ B、① ⑥ ⑦ C、除③ ④ 外都是 D、以上答案均错误
2. 限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐在溶液中反应,符合离子方程式2H++SO32-=H2O+SO2↑的化学方程式个数有
A.4 B.5 C.8 D.都不正确
3.某溶液可能含有Na+、Ag+、Al3+、AlO2―、S2-、CO32-、SO32―、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列结论中不正确的是( )
A.此溶液中一定有S2-、SO32―、Na+ B.此溶液中可能有AlO2―、CO32-
C.此溶液中一定没有Ag+、Al3+ D.此溶液中可能有S2-和NO3-
4、0.1 mol 铜与40 mL 10 mol·L-1HNO3充分反应后,溶液中含a mol H+,由此可知
A.生成的气体在标准状况下的体积为4.48 L B.生成的气体在标准状况下的体积为1.49 L
C.被还原的硝酸的物质的量为(0.2-a) mol
D.反应后溶液中所含NO3-的物质的量为0.2 mol
5.化学与生活是紧密相联的,下列关于生活化学的说法正确的是
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,它们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
6.从宏观方面来说物质由元素组成,从微观方面来说物质由粒子构成。下列说法中不正确的是
A.![]() Fe与
Fe与![]() Fe互为同位素 B.只由一种分子组成的物质一定为纯净物
Fe互为同位素 B.只由一种分子组成的物质一定为纯净物
C.质子数等于电子数的某微粒,可能是一种分子或一种离子
D.46gNO2和46gN2O4含有的原子数相等
7.氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是 ( )
A.冶炼铁的主要原料有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用是除去铁矿石中的脉石(二氧化硅)的。
B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C.用磁铁矿炼铁的反应中,1mol Fe3O4被CO还原成Fe,转移9mole—
D.铝热法还原铁的反应中,放出的热量能使铁熔化
8.a mol FeS与b mol FeO投入到V L、C mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)×189g C.(a+b)mol D.(CV-![]() )mol
)mol
9.为证明CuSO4溶液显蓝色与Cu2+有关而与SO42-无关,某同学设计了下列实验,其中对实验目的没有意义的是
① 观察稀硫酸颜色 ② 观察无水硫酸铜粉末颜色 ③ 稀释CuSO4溶液,观察溶液蓝色变化
④ 往CuSO4溶液中滴加少量NaOH溶液,生成蓝色沉淀,过滤,观察滤液颜色变化
⑤往CuSO4溶液中滴加足量Ba(OH)2溶液,生成蓝色沉淀,过滤,观察滤液颜色变化
⑥往CuSO4溶液中滴加足量BaCl2溶液,生成白色沉淀,过滤,观察滤液颜色变化
A.有二项操作 B.有三项操作 C.有四项操作 D.都没有意义
10.将氨水滴加到盛有AgC1的试管中,AgC1逐渐溶解,对上述过程,下列叙述或解释中正确的有
A.所得溶液中c(Ag+)×c(C1-)<KSP(AgC1) B.所得溶液中形成了难电离的物质
C.上述实验说明C1—与NH4+间有很强的结合力D.上述过程中NH3·H2O的电离程度增大
11.下列说法中,不正确的是
A. 在NaAlO2溶液中,HSO3-(H2SO3的电离常数K1=1.5×10-2;K2=1.0×10-7)不可能大量存在
B. 在0.1mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C. 在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D. 室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
12.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
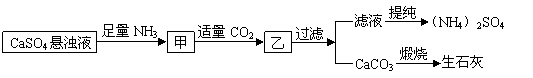 |
下列推断不合理的是 ( )
A.直接蒸干滤液得到纯净的(NH4)2SO4B.生成1mol(NH4)2SO4至少消耗2molNH3
13、蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
14.实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为lmol·L-1。下面四个选项中能达到此目的的是
A.NH4+、Na+、NO3-、Cl- B.Cu2+、K+、SO42—、NO3—
C.H+、K+、HCO3-、Cl— D.Mg2+、Na+、Cl—、SO42—
15.t℃时CuSO4的溶解度是S g,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1。向足量饱和溶液中加入m g无水CuSO4或蒸发掉n g水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
16.有10 g不纯CaCO3样品与足量盐酸作用后生成4.44 g CO2,且溶液中残留难溶物质。则对于此样品中是否存在①MgCO3 ②K2CO3 ③SiO2杂质的判断正确的是( )
A.肯定含①③,不含② B.肯定含①③,可能含② C.肯定含②③,不含① D.肯定含②③,可能含①
17.某学生用NaHCO3,和KHCO3,组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
| 50mL 盐酸 | 50mL 盐酸 | 50mL 盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0mol·L
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量 D.15.7g混合物恰好与盐酸完全反应
18.在医学、日常生活中常见的溶液:①福尔马林②医用消毒酒精③生理盐水④食醋,这些溶液中的溶质质量分数由大到小顺序为( ).
A.①②③④ B.②①③④ C.②④①③ D.②①④③
19.对于Al与重氢氧化钠(NaOD)的水溶液反应,下列说法正确的是
A.生成的氢气中只含有D2 B.生成的氢气中含有H2、HD、D2
C.生成的氢气中只含有H2 D.以上判断都不正确
20.要求设计实验证明: 某种盐的水解是吸热的,有四位同学分别作出如下回答,不正确的是:
A. 甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 乙同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明盐类的水解是吸热的
C. 丙同学:通过实验发现同浓度的热的纯碱液比冷的纯碱液去油污效果好,说明碳酸钠水解是吸热的
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的
21.(12分)镉是银白色或有蓝色光泽的软质金属,具延展性,密度:8.642克/厘米3。熔点:320.9℃。沸点765℃。常见化合价为+2价。不溶于水,溶于大多数酸中。在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍—镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
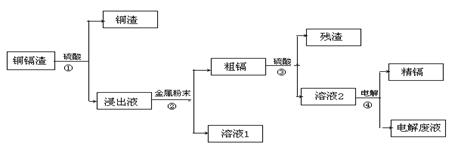
请回答下列问题:
(1)写出步骤①反应的离子方程式 。
(2)步骤②所加入的金属的名称是 ,为了实现绿色化学的目标,应如何处理“溶液1”? 。
(3)步骤④用“溶液2”作电解液,镉在 极析出,该电极反应式是
(4)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝沉淀镉离子。写出加入硫化钠溶液沉淀镉离子的离子方程式 。
![]()
![]()
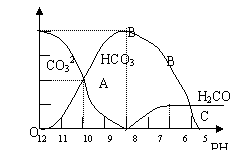 22.(13分)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示
22.(13分)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示
回答下列问题:
(1)20mL 0.1mol/LNa2CO3溶液呈碱性的原因是(用离子方程式表示): ;其溶液中所有阳离子和阴离子的浓度有何关系?(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
(3)若向20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则KSP(X)= 。
(4)当加入盐酸使溶液PH为10时,混合液中含碳元素的离子有哪些? ,其物质的量之比为 。
(5)请写出OAB段的离子方程式 ;当混合液的PH= 时,开始放出CO2气体。
23.(10分)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为硫酸锶,含不溶性杂质)为原料,采用以下两种方法制取碳酸锶,进而制得多种锶的化合物。
方法一:将天青石粉碎后在1000℃~1200℃时与碳在还原气氛中反应制得硫化锶。向硫化锶溶液中通人CO2得到碳酸锶。
方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加热l~2 h,经过滤、洗涤,得到碳酸锶。
(1)方法一将天青石粉碎的目的是__________________ 。写出用碳还原天青石反应的化学方程式:_____________________________________。
(2)方法二的反应能够发生,说明______________ 。为了使该反应充分进行,还可以采取的措施是__________。
(3)两种方法中得到的碳酸锶纯度较高的是_______________(填“方法一”或“方法二”),理由是______________________________________________。
(4)下列关于锶及其化合物的叙述中,正确的是___________。
A.离子半径:Ba2+>Sr2+>Ca2+ >Be2+ B.碱性:Ba(OH)2>Sr(OH)2>Ca(OH)2
C.SrCO3高温分解可以制取SrO D.SrCO3与HNO3溶液反应可制取Sr(NO3)2
24.(10分)根据侯德榜制碱法原理并参考下表数据,实验室制备纯碱Na2CO3的主要步骤是: 将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
| 温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①>35℃NH4HCO3会有分解请回答:
⑴ 反应温度控制在30—35℃,是因为若高于35℃,则________________________,
若低于30℃,则_____________________________,为控制此温度范围,采取的加热方法为____________________________________________________________。
⑵ 加料完毕后,继续保温30分钟,目的是__________________________。
静置后只析出NaHCO3晶体的原因是____________________________。
用蒸馏水洗涤NaHCO3晶体的目的是除去_______________杂质(以化学式表示)
⑶ 过滤所得的母液中含有___________________________(以化学式表示),需加入_______,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl
⑷ 测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32—+H+==HCO3—反应的终点),所用HCl溶液的体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3% = _____________。
参考答案
1、D 2、C 3、A 4、C 5、B 6、C 7、C 8、BD 9、B
10、B 11、C 12、A 13、B 14、AD 15、C 16、B 17、BD 18、D 19、B 20、A
21.(共12分)(1)Zn+2H+=Zn2++H2↑(2分) Cd+2H+=Cd2++H2↑(2分)
(2)Zn(1分),电解回收金属Zn (或者加入适量的生石灰,过滤;或者加入适量的氢氧化钡,过滤) (2分)(3)阴极(1分);Cd2+ +2e- =Cd(2分)(4)Cd2+ +S2- =CdS↓(2分)
22、CO2-3 +H2O-3+OH- (2分);C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-)(2分)
(1) 用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。(3分)
(3)8.0×10-9(2分)
(4)CO32-和HCO3-(1分) 1︰1(1分) (5) CO32-+H+=HCO3- (1分);6 (1分)
23.(10分)
(1)增大反应物接触面积,提高反应速率,提高原料的利用率(2分)
 |
六、(本题包括2小题,共18分)
24.(10分)⑴ NH4HCO3分解 反应速率降低 水浴加热
⑵ 使反应充分进行 NaHCO3的溶解度最小 NaCl NH4Cl NH4HCO3
⑶ NaHCO3 NaCl NH4Cl NH4HCO3 NaCl和NH3(各1分)
⑷ 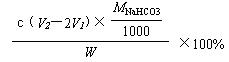 (2分)
(2分)