08届高三年级化学上册第二次月考试题
化 学 试 题
本试卷分Ⅰ、Ⅱ两卷,分别为选择题和非选择题。共120分,考试时间100分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 A1 27 Si 28
S 32 C1 35.5 K 39 Ca 40 Cu 64 Br 80 I 127
第Ⅰ卷(选择题共56分)
一、单项选择题:本题包括8小题,每小题3分,共计24分。每小题只有一个选项符合题意。
1.下列各组物质的分类都正确的是(括号里的是类别)
A.NaCl溶液(混合物)、HNO3(离子化合物)、CO2(非电解质)
B.液氨(氢化物)、NH4NO3(铵盐)、BaSO4(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、KO2(碱性氧化物)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO2(有机物)
2.下列描述中,符合化学科学的是
A、“曾青得铁则化为铜”中的“曾青”是指硝酸铜
B、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
C、“玉不琢不成器”、“百炼方能成钢”的说法都与物质的化学变化无关
D、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂
3.运用化学知识可以解决日常生活中遇到的许多问题,下列说法不正确的是
A.食用松花蛋时蘸些食醋可以去除氨味
B.用双氧水的稀溶液清洗伤口可以杀菌消毒
C.用淀粉溶液检验食盐是否为加碘盐
D.用稀硝酸回收利用破碎热水瓶胆内的银
4.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质: ①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液
④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是
A.①③ B.③④ C.①② D.①③④
5.下列各项中表达不正确的是
A.Si的原子结构示意图:![]()
B.NH3的电子式:![]()
C.聚乙烯的结构简式: ![]() n
n
D.29Cu的核外电子排布式:【Ar】3d104s1
6.下列观点中不正确的是
A.通过化学变化一定能改变物质的性质
B.改变物质的性质一定要通过化学变化
C.氧化还原反应中一定会发生电子转移
D.有电子转移的化学反应一定是氧化还原反应
7.今有0.1 mol·L-1 Na2SO4溶液300 mL,0.1 mol·L-1 MgSO4溶液200 mL和
0.1 mol·L-1 Al2(SO4)3溶液100 mL,这三种溶液中硫酸根离子浓度之比是
A.1∶1∶1 B.3∶2∶1
C.3∶2∶3 D.1∶1∶3
8.具有下列电子排布式的原子中,半径最大的是
A.ls22s22p63s23p5 B.1s22s22p3
C.1s22s22p2 D.1s22s22p63s23p4
二、不定项选择题:本题包括8小题,每小题4分,共计32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。
9.下列说法或表示方法正确的是
A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l);△H = -57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B.由C(石墨)= C(金刚石);△H = +1.90 kJ·mol-1可知,金刚石比石墨稳定
C.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
D.在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+ O2(g)= 2H2O(l);△H = -571.6 kJ·mol-1
10.下列是几种原子的基态电子排布式,其中电负性最大的原子是
A.1s22s22p4 B.1s22s22p63s23p3
C.1s22s22p63s23p2 C.1s22s22p63s23p64s2
11. 已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是
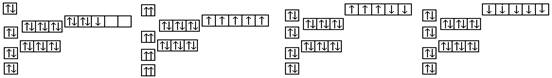
A
B
C
D
12. 对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等
13. 在加入铝粉能放出H2的溶液中,肯定不能大量共存的离子组是
A. Fe3+、NO3-、Cl-、Na+
B.Ba2+、Mg2+、HCO3-、AlO2-
C.NO3-、Na+、K+、CO32-
D.NO3-、K+、AlO2-、OH-
14.下列离子方程式书写正确的是
A.硫酸铁溶液中加入足量铁粉:Fe3++Fe=2Fe2+
B.在硫酸溶液中加入氢氧化钡溶液至pH=7:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.碳酸氢铵溶液与足量稀盐酸溶液混合: HCO3-+H+= CO2+ H2O
D.在氯化铝溶液中加入过量的氨水: Al3+ +4NH3×H2O =AlO2-+4NH4++2H2O
15.下列说法中错误的是
A、原子及其离子的核外电子层数等于该元素所在的周期数;
B、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素;
C、除氦外的稀有气体原子的最外层电子数都是8;
D、同一元素的各种同位素的物理性质、化学性质均相同
16.根据下列五种元素的电离能数据(单位:kJ/mol)推测,在周期表中,最可能处于同一族的是
A. Q和R B. S和T C. T和U D. R和U
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
 化 学 答 题 卷
化 学 答 题 卷
第Ⅰ卷 选择题:(共56分)
| 题号: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案: | ||||||||
| 题号: | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案: |
第Ⅱ卷 非选择题(共64分)
三、本题包括3小题,共计28分。
17.(10分) (1)下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
| A | B | ||||||||||||||||
| C | M | D | E | ||||||||||||||
| F | G | H | I | ||||||||||||||
| N | J | ||||||||||||||||
| K | L |
1上述所列元素的原子中,最外电子层上只有两个电子的是__________ (填“元素符号”);
2下列叙述正确的是_____________(填字母序号);
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
 |
d.N的电子排布式:ls22s22p63s23p63d44s2
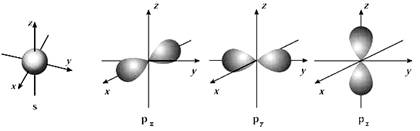
(2)下面是s能级和p能级的原子轨道图,试回答问题:
1s电子的原子轨道呈 形;p电子的原子轨道呈 形,每个p能级有
个原子轨道。
2 某元素的原子获得能量后的电子排布式为1s2 2s22p6 3s23p3 4s1,则该元素的原子获得能量前的电子排布式为 ;元素符号为 。
| 物质 | 熔点/oC | 沸点/oC | 密度/g·cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
18、(10分)A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B________,D________。
(2)A、C形成的离子化合物与CO2发生非氧化还原反应的化学方程式
__________________ 。
(3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水
及一种气体,写出该反应的化学方程____________________________。
(4)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺为
____________________________________________。
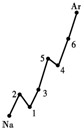
19.(共8′) 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)
所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
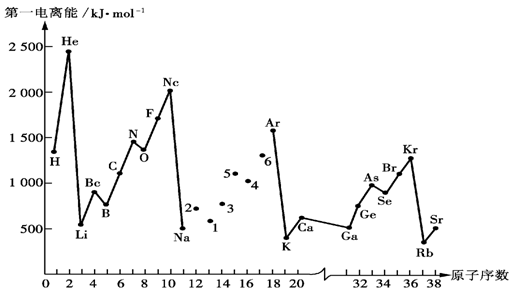
请回答以下问题:
⑴ 认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵ 从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________
_____________________________;
⑶ 上图中5号元素在周期表中的位置是_____________、_______________;
⑷ 上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
四、本题包括3小题,共计26分。
20.(8分)(1)向![]() 溶液中,逐滴加入
溶液中,逐滴加入![]() 溶液至中性,写出发生反应的离子方程式:
溶液至中性,写出发生反应的离子方程式:
________________________________________.
在以上中性溶液中,继续滴加![]() 溶液,写出此步反应的离子方程式:
溶液,写出此步反应的离子方程式:
________________________________________.
(2)向![]() 溶液中,逐滴加入
溶液中,逐滴加入![]() 溶液至恰好不再生成沉淀为止,写出反应的离子方程式:
溶液至恰好不再生成沉淀为止,写出反应的离子方程式:
________________________________________.
在以上溶液中,继续滴加![]() 溶液,写出此步反应的离子方程式:
溶液,写出此步反应的离子方程式:
________________________________________.
21.(8分)某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4, 振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。回答下列问题:
(1)写出实验②中发生氧化还原反应的离子方程式
__________________________ ;
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是(填序号) ;
A.Br2>I2 B.Fe3+>Br2 C.Br2>Fe3+ D.I->Br-
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明。
①FeCl![]() 溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉液
溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉液
(友情提示:请写出实验步骤、现象及结论)________________________________ _ _________________________________________________________________
。
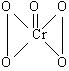 22.(10分)在过氧化氢中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚的缘故。CrO5 的结构式见下式。
22.(10分)在过氧化氢中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚的缘故。CrO5 的结构式见下式。
(1)在CrO5中氧元素的化合价为 ;
(2)这一反应的离子方程式是 ;
(3)这个反应 (填“是”或“不是”)氧化还原反应,其理由是
(4)如果将9.60×10-4molAO4-离子在溶液中还原成较低价态,需用0.100 mol•L-1H2O2溶液24.0mL,试通过计算确定A元素的最终价态 。
五、本题包括1小题,共计10分。
23.(10分)氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312 g,放入烧杯中,加入适量6 mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35 mL 0.25 mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05 mol/L KMnO4溶液16 mL,恰好完全反应。
回答下列问题:
(1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)。
参考答案
选择题:(共56分)
| 题号: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案: | B | B | C | A | B | B | D | D |
| 题号: | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案: | AD | A | D | C | AB | BC | AD | D |
17.(10分) (1)He、Be、Fe (3分) a、c (2分)
⑵(每空1′,共5′)⑴球,纺锤,3; 1S22S22P63S23P4(或[Ne] 3S23P4)、S 。
 18、(1)F Mg
18、(1)F Mg
(2)Na2O+CO2=Na2CO3
(3)2F2+2NaOH=2NaF+OF2+H2O
(4)c(Na+)>c(F-)>c(OH-)>c(H+)
19.(每小题2′,共8′)⑴见上图(右)
⑵从上到下依次减小; ⑶第三周期,ⅤA族;
⑷因同主族上一周期的元素的氢化物分子间存在氢键
20.(8分)
(1)![]() ;
;![]()
(2)![]() ;
;![]()
21.(8分)(1)2F3++Br2 = 2Fe3+ +2Br- (2分) (2)A、C (2分)
(3)取少量FeCl3溶液于试管中,依次加入KI溶液和淀粉液,振荡,淀粉液变蓝,证明Fe3+氧化性强于I2。(4分)
22. (10分)(1)一个氧为-2价,4个氧为-1价。(2分)
(2) Cr2O72- + 4 H2O2 +2H+ = 2CrO5 +5H2O (2分)
(3)不是;化学反应前后元素的化合价不变。(4分)
(4)2 (2分)
23.(10分) (1)2、5、6、2、10、8 (3分)
(2)酸式、当看到滴入1滴KMnO4溶液时,锥形瓶中溶液立即变成紫红色,且半分钟内不褪色,即达到滴定终点。(3分) (3)34.60%