08届高三年级化学二月份调研卷
(考试时间:120分钟;满分:150分)
学校________________班级__________姓名___________得分____________
相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 K-39 Ca-40 Mn-55
第Ⅰ卷(共66分)
考生注意,请将选择题的答案填在表格中
一.选择题(本题共10分),每小题2分,只有一个正确选项。
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 |
1.下列物质与相应现象不相关的是( )
A. SO2:酸雨 B. CO2:温室效应
C. 氯气:富营养污染 D. 氟氯烃:臭氧层空洞
2.下列物质的俗名错误的是( )
A. Ca(OH)2:生石灰 B. HCHO:蚁醛 C. C6H5OH:石炭酸 D. Na2CO3:纯碱
3.以下化学用语正确的是( )
A. 乙炔的最简式:CH≡CH B. 乙酸乙酯的分子式:C4H8O2
C. CO2的电子式:![]() D. S2—的最外层电子排布式:3s23p4
D. S2—的最外层电子排布式:3s23p4
4.以NA表示阿伏加德罗常数,下列判断错误的是( )
A. NA个质子的质量约为1 g B. 32 g S2和S4的混合物含有NA个S原子
C. 0.5 mol Na2O2含有NA个阴离子 D. 标准状况下, 1 mol己烷含有NA个分子
5.以下“新闻”肯定是伪科学的是( )
A. 发现了铁元素+8价的化合物 B. 制得了能溶解任何物质的溶剂
C. 发现微量的NO有益健康 D. 找到了常温常压下合成氨的催化剂
二.选择题(共36分),每小题3分,只有一个正确选项。
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 |
6.具有相同电子层数的X、Y、Z三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
A. 原子半径:X>Y>Z B. 元素的非金属性:X>Y>Z
C. 气态氢化物的稳定性:HX<H2Y<ZH3 D. 阴离子的还原性:X->Y2->Z3-
7.利用下列各组物质制备和收集气体,能采用右图装置的是( )
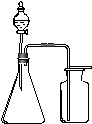 A. 浓氨水与生石灰反应制NH3
A. 浓氨水与生石灰反应制NH3
B. 浓盐酸与二氧化锰反应制Cl2
C. 过氧化氢溶液与二氧化锰反应制O2
D. 电石与饱和食盐水反应制C2H2
8.有关晶体的下列说法中正确的是( )
A. 晶体中分子间作用力越大,分子越稳定 B. 原子晶体中共价键越强,熔点越高
C. 干冰融化时分子中共价键发生断裂 D. 氯化钠溶于水时离子键未被破坏
9.以下物质的制备原理错误的是( )
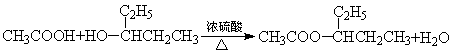
A. 无水氯化镁的制备 :MgCl2·6H2O![]() MgCl2+ 6H2O
MgCl2+ 6H2O
B. 钴的制备:3Co3O4+8Al![]() 9Co+4Al2O3
9Co+4Al2O3
C. 烧碱的制备:2NaCl+2H2O![]() 2NaOH +H2↑+ Cl2↑
2NaOH +H2↑+ Cl2↑
D. 漂粉精的制备: 2Ca(OH)2+ 2Cl2→Ca(ClO)2 +CaCl2+2H2O
10.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化合物的化学式可以表示为( )
A. B3A2 B. BA2 C. A3B2 D. AB2
11.关于如图所示装置的叙述,正确的是( )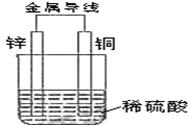
A. 铜是阳极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 氢离子在铜片表面被还原
12.在含氧酸中有一种称为原某酸的,它们的性质都不稳定。例如,原硅酸的化学式为H4SiO4;原碳酸的化学式为H4CO4,据此可推知,下列结构简式中属于原甲酸乙酯酯类的是( )
A. C(COC2H5)4 B. CO(OC2H5)2 C. H2C(COC2H5)2 D. HC(OC2H5)3
13.以下实验装置不用于分离物质的是( )
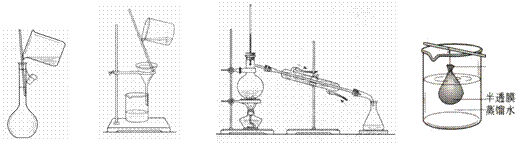
A B C D
A. B C D
14.下列实验用错试剂的是( )
A. 用水萃取乙酸乙酯中的乙酸 B. 用碱石灰吸收氨气中的水蒸气
C. 用热碱溶液除去待镀铁件表面的油污 D. 用稀硝酸清洗试管内壁附着的银
15.常温下,测得某氨水溶液的pH 约为12,将其与0.01 mol/L的盐酸等体积混合后,所得溶液中物质的量浓度最大的离子是( )
A. Cl- B. NH4+ C. H+ D. OH-
16.根据有关化学原理,下列判断正确的是( )
A. 常温下,弱酸A的浓度小于弱酸B,则A的电离度一定大于B
B. 晶体A易溶于CCl4,则A一定是分子晶体
C. 在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属
D. 能量低的状态更稳定,则自然界的物质都以能量最低的形态存在
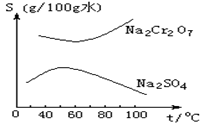 17.根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到 Na2Cr2O7,需要进行三个操作。
17.根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到 Na2Cr2O7,需要进行三个操作。
这三个操作不包括( )
A. 升温结晶 B. 趁热过滤
C. 降温结晶 D. 蒸发结晶
三.选择题(本题共20分),每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
18.可逆反应A(g)+ B(s) ![]() 2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
A. 增大B物质的量 B. 升温 C. 减压 D. 使用适宜催化剂
19.下列离子方程式正确的是( )
A. 氢氧化钡溶液中滴加稀硫酸:Ba2++OH-+ H++SO42- →BaSO4↓+H2O
B. 饱和碳酸钠溶液通入二氧化碳后溶液浑浊:2Na++CO32-+CO2+H2O → 2 NaHCO3↓
C. 少量SO2用氨水吸收:2NH3·H2O + SO2 → 2NH4+ + SO32- +H2O
D. 往明矾溶液中加入氢氧化钡溶液至Al3+完全沉淀:
Al3+ + 2 SO42— + 2 Ba2+ + 3OH — → Al(OH)3↓+ 2BaSO4↓
20.原硅酸的分子式为H4SiO4,其分子结构有4个羟基,由若干个原硅酸分子间脱水形成的物质通常用xSiO2·yH2O表示其组成,若有三个原硅酸分子脱水,此过程脱去的水分子数与y的值分别为( )
A. 3、4 B. 2、4 C. 3、3 D. 3、8
21.以下决定物质性质的因素全面、正确的是( )
A. 元素的化学性质:元素原子的最外层电子数 B. KNO3的溶解度:温度
C. 分子间作用力:相对分子质量 D. 气体摩尔体积:温度、压强
22.充分灼烧a g某含C、H、O元素的有机物时,测得生成了b g CO2和c g H2O,则以下判断正确的是( )
A. 肯定能确定该物质的最简式 B. 肯定不能确定该物质的最简式
C. 肯定不能确定该物质的分子式 D. 肯定不能确定该物质的结构式
第Ⅱ卷 (共84分)
四、(本题共24分)
考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
23(A)
下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
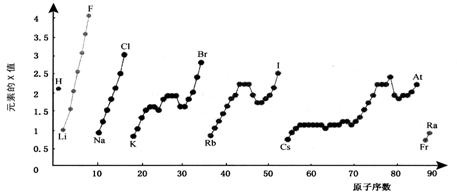
(1)短周期中原子核外p亚层上电子数与s亚层上电子总数相等的元素是______(写元素符号)。
(2)同主族内不同元素的X值变化的特点是_________________________,同周期内,随着原子序数的增大,X值变化总趋势是________________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)X值较小的元素集中在元素周期表的_____________。
a. 左下角 b. 右上角 c. 分界线附近
(4)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律
b. X值可反映原子在分子中吸引电子的能力
c. X值大小可用来衡量元素金属性和非金属性的强弱
23(B)
下图为周期表中原子体积(单质原子的摩尔体积)随原子序数变化的关系。
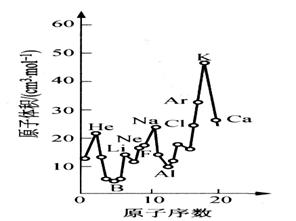
(1)第二周期原子体积最大的元素形成的固态单质属于_________________晶体。第三周期原子体积最小的元素核外电子排布式为_________________________。
(2)试预测下列元素原子体积的关系:Se _____ Br;Xe _____ Ba(选填 >、 = 或 < )。
(3)从图中可以得出的结论有______________(选填代号)。
a. 同一周期中,原子体积先由大变小,而后又由小变大
b. 每一周期中,碱金属的原子体积最大
c. 同一主族中从上到下,原子体积一般总是逐渐减小
(4)由此可见,在元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律。试写出一条Ⅶ族元素所形成的化合物某种性质的变化规律:
_______________________________________________________________。
24.某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI。
(1)用这五种物质组成一个合理的未配平的方程式:
____________________________________________________。
(2)若水是产物,请配平该反应的方程式,并标出电子转移方向与数目:
_____________________________________________________。
(3)pH为5—9时,体系中的氧化反应为HI→I2;当pH < 4时,反应方向改变,此时体系中的氧化反应为:_______ → ________。
(4)该反应表明溶液的酸碱性影响物质的______________________(填物质的性质)。
25.
甲烷蒸气转化反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
已知温度、压强和水碳比[![]() ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图:
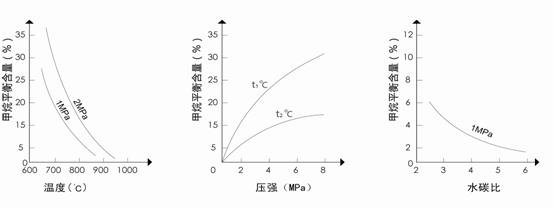
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
(1)该反应平衡常数K表达式为________________________。
(2)升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同),降低反应的水碳比,平衡常数K__________。
(3)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(4)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是____________________________。
五、(本题共24分)考生注意:26题为分叉题,分为A、B两题,考生可任选一题。若两题均做,一律按A题计分。
26(A)、为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下三种实验方案:
方案I:取25.00 mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀, 称重,其质量为m2 g
方案Ⅲ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O),消耗KMnO4溶液b mL。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和__________________、_________________。
(2)在方案Ⅲ中滴定时是否需要选择指示剂? _____________ (填“需要”或“不需要”)。滴定终点的颜色变化是_______________________________。
(3)写出Na2SO3固体氧化变质的化学方程式_____________________________________。
(4)用方案Ⅲ的实验数据,计算Na2SO3的纯度为__________________。
(5)实验中发现,方案Ⅱ测定的Na2SO3纯度比方案I和方案Ⅲ的结果都要低得多。试分析产生上述现象的原因
_______________________________________________________________________________________________________________________________________________。
(6)请再设计一个测定Na2SO3固体的纯度的实验方案。
___________________________________________________________________________________________________________________________________________________。
26(B).
下图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸强氧化性并观察还原产物的实验装置。
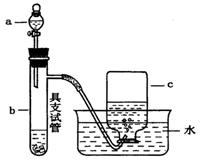
Ⅰ.浓硝酸的强氧化性实验
将铜片置于具支试管的底部,在分液漏斗中加入约5mL浓硝酸,往具支试管中放入约2mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式为_______________________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象是___________________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是_____________________________________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是__________(填写代号)。
A. c中收集到无色气体;
B. c中收集到的无色气体接触空气后变为红棕色;
C. b中产生的无色气体接触空气后变为红棕色;
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是___________________________________________________________。
Ⅳ.问题讨论
用等质量铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因,是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法_________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明。
___________________________________________________________________。
27.
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
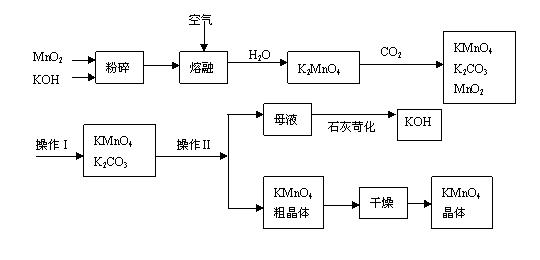

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
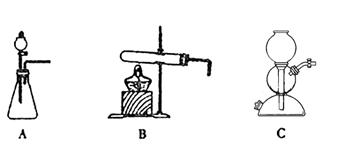
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
六.(本题共20分)
28.
尼泊金酸的结构简式为: ![]()
(1)尼泊金酸的分子式为____________。
(2)尼泊金酸不具有的性质是_________(选填序号)。
a. 可溶于水 b. 通常状况下呈固态 c. 发生消去反应 d. 遇FeCl3溶液显紫色
(3)1 mol尼泊金酸与下列物质反应时,最多可消耗__________(选填序号)。
a. 4 mol H2 b. 2 mol NaHCO3 c. 2 mol Br2 d. 2 mol Na2CO3
(4)将尼泊金酸与足量NaOH固体混合后灼烧,生成的有机物结构简式为_________________。
(5)尼泊金酸有多种同分异构体,写出以下含有苯环的同分异构体的结构简式:
ⅰ酯类___________________________;ⅱ醛类___________________________。
29.
烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:
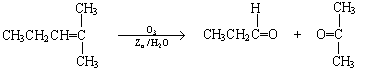 |
一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。G的分子式为C7H14O2。有关转化关系如下;
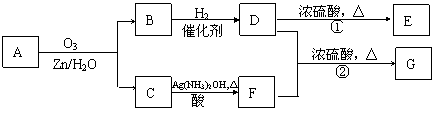 |
(1)B的相对分子质量是__________________。
(2)写出结构简式:A__________________、E_______________________。
(3)写出反应①、②的反应类型:①________________、②_______________。
(4)写出反应②的化学方程式:__________________________________________。
(5)F的一种同分异构体能发生酯化反应和银镜反应,其结构简式为___________________。
七、(本题共16分)
30.石膏是一种节能建筑材料。某石膏样品是由二水石膏(CaSO4·2H2O)、半水石膏(CaSO4·![]() H2O)、无水石膏(CaSO4)三种成分组成,各组分含量可用下列方法测定。
H2O)、无水石膏(CaSO4)三种成分组成,各组分含量可用下列方法测定。
①称取8.70 g该石膏试样,在400℃干燥失去全部结晶水,质量变为8.16 g。
②再称取8.70 g的该石膏试样,加入80%的酒精溶液,使CaSO4完全水化成CaSO4·![]() H2O,此时,其它两组分与酒精溶液不起作用;将试样取出干燥后称量,试样质量变为8.97 g。
H2O,此时,其它两组分与酒精溶液不起作用;将试样取出干燥后称量,试样质量变为8.97 g。
③在②中所得8.97 g试样中加入蒸馏水,使全部的CaSO4·![]() H2O都水化成CaSO4·2H2O,取出干燥后再次称量,质量变为10.32 g。
H2O都水化成CaSO4·2H2O,取出干燥后再次称量,质量变为10.32 g。
(1)试样中结晶水的质量分数为__________________。
(2)试样中无水石膏(CaSO4)的物质的量为____________ mol。
(3)试样中三种石膏的物质的量之比为:
n(CaSO4·2H2O)∶n(CaSO4·![]() H2O)∶n(CaSO4)= __________________。
H2O)∶n(CaSO4)= __________________。
31.工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是_______________________。
(3)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率![]()
![]() =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(4)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率![]() 为何值?
为何值?
高三化学调研卷参考答案与评分标准
一、选择题(共10分,每小题只有一个正确选项。)
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 | C | A | B | C | B |
二、选择题(共36分,每小题3分,只有一个正确选项)
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 | B | C | B | A | B | D | D | A | A | B | B | D |
三、选择题(本题共20分,每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分:有两个正确选项的,选对一个给2分,选错一个该小题不给分。)
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 | B、D | B、C | B、C | B、D | A |
四、(本题共24分)
23(A)(8分)
(1)O,Mg(2分);
(2)同一主族,从上到下,X值逐渐减小(1分);逐渐增大(1分);周期性(1分);
(3)a(1分);(4)bc(2分)
23(B)(8分)
(1)分子(1分);1s22s22p63s23p1(1分); (2)<(1分)、>(1分);(3)ab(2分);
(4)从上到下,气态氢化物稳定性逐渐减弱(答案合理即给分)(2分);
24.(8分)
(1)Na3AsO3+H2O+I2→Na3AsO4+HI或Na3AsO4+HI→Na3AsO3+H2O+I2(2分,写出一个即可)
(2)
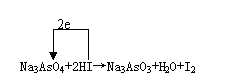
 (3分=2+1)
(3分=2+1)
(3)Na3AsO3→Na3AsO4(2分);(4)氧化还原性(1分)
25.(8分)
(1)K=![]() (2分);(2)增大(1分);不变(1分);(3)<(1分);
(2分);(2)增大(1分);不变(1分);(3)<(1分);
 (2分)
(2分)
(4)防止催化剂中毒(1分);
五、(本题共24分)
26(A).(12分)
(1) 电子天平(1分);250mL的容量瓶(1分);
(2)不需要(1分),紫色不褪色(1分)。 (3)2Na2SO3+O2→2Na2SO4(2分)
(4)![]() (2分);
(2分);
(5)盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,遇Ba2+结合生成BaSO4沉淀,沉淀质量偏大,导致含量偏高(2分)。
(6)称取样品m1g,加入过量盐酸,测定放出SO2的体积或质量;或其他合理答案(2分)
26(B).(12分)
(1)Cu+4HNO3(浓)→Cu(NO3)2+2NO2↑+2H2O(2分)
(2)生成蓝色溶液,放出红棕色气体;(2分)
(3)往分液漏斗中加水稀释浓硝酸,打开活塞,放入稀硝酸(2分)
(4)C(1分)
(5)利用Cu与浓硝酸反应生成的NO2排出具支试管中的空气,有利于观察Cu与稀硝酸反应产物。(2分)
(6)②(1分);将绿色溶液加水稀释,得到蓝色溶液或往蓝色溶液中通入NO2或加热绿色溶液,有红棕色气体产生,溶液变成蓝色(2分)
27.(12分)
(1)ab(2分);(2)d(1分);(3)MnO2;KOH(2分);(4)![]() (1分);
(1分);
(5)cd(2分);A(1分);
(6)过滤(1分);溶解度(1分);浓缩结晶(只填“结晶”不给分)(1分);
六.(本题共20分)
28.(8分)(1)C7H6O3(1分);
(2)c(1分);
(3)c.d(2分);
(4)
 (2分);
(2分);
(5) ⅰ: 等(1分);ⅱ:
等(1分);ⅱ: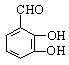 (1分)。
(1分)。
29.(12分)(1)86(2分);
(2)A:![]() (2分);E :
(2分);E :![]() (2分);(3)消去反应、酯化反应(2分);
(2分);(3)消去反应、酯化反应(2分);
(4) (2分);
(2分);
(5)![]() (2分)。
(2分)。
七、(本题共16分)
30.(5分)
(1)0.06(1分);(2)0.03mol(2分);(3)1∶2∶3(2分)
31.(11分)
(1)425.6(2分);
(2)![]() mol< n(CO2)<
mol< n(CO2)<![]() mol(2分);
mol(2分);
(3)设n(C)=1mol mol,n(CaCO3)=2.2 mol,当空气O2中与C完全反应生成CO2时,所得窑气中CO2体积分数最大。
C + O2 → CO2 CaCO3→CO2↑+CaO
1 1 1 2.2 2.2
CO2体积分数=![]() ×100%=44.4%(3分);
×100%=44.4%(3分);
(4)设窑气为100mol,则n(N2)=100-41.6-0.2-0.2=58mol,总共有n(O2)=58/4=14.5mol;故参加反应的n(O2)=14.5mol-0.2mol=14.3mol;
2C + O2 → 2CO C + O2 → CO2 CaCO3→CO2↑+CaO
2 1 2 1 1 1 1 1
0.2 0.1 0.2 14.2 14.2 14.2 27.4 27.4
n(CaCO3)=27.4mol;n(C)=14.4mol;
∴![]() =1.90(4分);
=1.90(4分);