08届高三化学二模热身试题
化 学
可能用到的相对原子量:H 1 C 12 N 14 O 16 K 39 Cr 52
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有1个选项符合题意)
1.下列关于有机化合物的说法正确的是( )
A.乙醇和乙酸都存在碳氧双键 B.甲烷和乙烯都可以与氯气反应
C.高锰酸钾可以氧化苯和甲烷 D.乙烯可以与氢气发生加成反应,苯不能与氢气加成
2.氧氟沙星是常用抗菌药,其结构简式如图所示,下列对氧氟沙星叙述错误的是( )
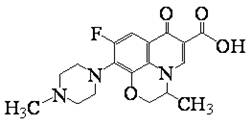 A.能发生加成、取代反应
A.能发生加成、取代反应
B.能发生还原、酯化反应
C.分子内共有19个氢原子
D.分子内共平面的碳原子多于6个
3.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②④ C.③④ D.②③
4. 有两种有机物组成的混合物,在一定的温度和压强下完全汽化为气体。在相同温度和压强下,只要混合气体体积一定,那么无论混合物以何种比例混合,它在完全燃烧时所消耗的氧气体积也是一定的。符合这种情况的可能是 ( )
A.C2H6O和C2H4O2 B.C2H4O和CH4O C.C3H6O和C3H8O3 D.C3H6O和C3H8O2
5.下列说法正确的是( )
A.乙烯的结构简式可以表示为CH2CH2 B.苯、乙醇和乙酸都能发生取代反应
C.油脂都不能使溴的四氯化碳溶液褪色 D.液化石油气和天然气的主要成分都是甲烷
6. 有机物CH2=CH-CH2-CH(OH)-COOH在不同条件下可能发生有机反应类型有:① 加成;② 取代;③ 消去;④ 氧化;⑤ 酯化;⑥ 加聚;⑦ 缩聚。其中因分子结构中含-OH而可能发生的反应有
A.③④⑤ B.①④⑥⑦ C.②③④⑤⑦ D.全部
7.右图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是
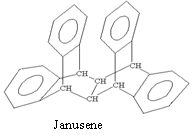 A.Janusene的分子式为C30H20
A.Janusene的分子式为C30H20
B.Janusene属于苯的同系物
C.Janusene苯环上的一氯代物有8种
D.Janusene既可发生氧化反应,又可发生还原反
8. 核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
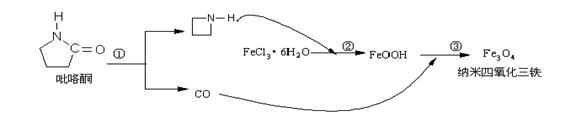
下列有关叙述不合理的是:
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.反应③的化学方程式是:6FeOOH +CO = 2Fe3O4 +3H2O + CO2
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意)
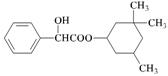 9. 环扁桃醋具有松弛血管平滑肌,扩张血管的功能,其结构简式如下图。下列对该物质叙述中,正确的是
9. 环扁桃醋具有松弛血管平滑肌,扩张血管的功能,其结构简式如下图。下列对该物质叙述中,正确的是
A.该物质属于芳香烃
B.该有机物难溶于水
C.分子式为C17H23O3
D.1 mol 该物质最多可与2 molNaOH发生反应
10. 新华网莫斯科2005年2月4日电:俄罗斯西伯利亚研究人员最近开发出一种生物活性吸附剂,可以吸附水中的几乎全部微生物和噬菌体。据俄《科学信息》杂志报道,这种新的吸附剂由成本低廉、环保性能好的棉纤维素和主要成分为氢氧化铝的勃姆石制造而成。下列有关说法中不正确的是
A.Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应
B.纤维素和淀粉互为同分异构体
C.纤维素能够与醋酸发生酯化反应
D.实验室中Al(OH)3可以由偏铝酸盐和氨水制备
11. 二〇〇八年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是
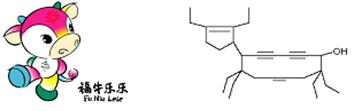
A.牛式二烯炔醇含有3种官能团,可以属于不饱和醇类
B.牛式二烯炔醇含有3个手性碳原子,与氢气完全加成反应后含有4个手性碳原子
C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应
D.牛式二烯炔醇分子内能发生消去反应,也能发生催化氧化反应
12. “魔棒”常被用于晚会现场气氛的渲染。其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:
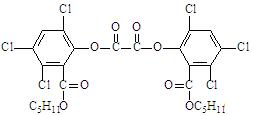
下列有关说法正确的是
A.草酸二酯属于芳香烃 B.草酸二酯的分子式为C26H23O8Cl6
C.草酸二酯难溶于水 D.1mol草酸二酯最多可与4molNaOH反应
13.被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。已被26个亚非国家指定为疟疾治疗用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示。有关该化合物的叙述正确的是( )
A.分子式为:C16H22O5
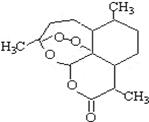 B.该化合物在一定条件下不能与NaOH溶液反应
B.该化合物在一定条件下不能与NaOH溶液反应
C.该化合物中含有过氧键,一定条件下有氧化性
D.青蒿素与维生素一样是水溶性的
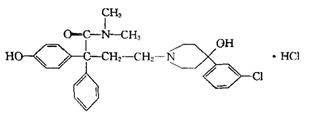
14.盐酸洛派丁胺俗称易蒙停,它是一种新型的止泻药,适用于各种急慢性腹泻的治疗,其结构简式如图:下列说法不正确的是
A.易蒙停的分子式为C29H34Cl2N2O3
B.向易蒙停溶液中加入FeCl3溶液,溶液显紫色
C.1mol易蒙停只能与lmolNaOH发生反应
D.lmol易蒙停最多能与3mol溴水发生反应
三、(本题包括2小题,共16分)
15. 某工厂的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯。以上各物质的沸点如下:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
现拟通过下列步骤回收乙醇和乙酸:①向废液中加入烧碱溶液,调整溶液的pH=10;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入浓硫酸(过量),然后再放入耐酸蒸馏器中进行蒸馏,收集馏出物,请回答下列问题:
(l)加入烧碱使溶液的 pH=10的目的是________________________________
(2)在70℃~85℃时馏出物的主要成分为____________________________________。
(3)在步骤④中加入过量的浓硫酸的目的是(用化学方程式表示)
_______________________ 。
(4)最后蒸馏的温度控制在85℃~125℃之间,经过一段时间后,蒸馏瓶中残留液中溶质的主要成分是__________________________。
16.实验室里可用甲醇等有关物质制备HCHO,关于甲醇和甲醛的沸点和水溶性见下表:
| 沸点(℃) | 水溶性 | |
| 甲醇 | 65 ℃ | 与水混溶 |
| 甲醛 | -21 ℃ | 与水混溶 |
某校化学兴趣小组的甲、乙两位同学,在研究性学习中,运用以上信息和已有知识分别设计了二套实验室制取HCHO装置,如图甲和乙。据此请你回答下列问题:
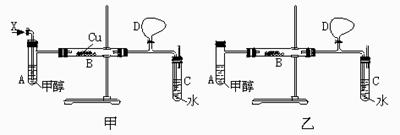
(1)若按甲装置进行实验,则通入A试管的X应是________;B中反应的化学方程式是___________________ 。
(2)若按乙装置进行实验,则B管中应装入________。
(3)当实验完成时,若在C中滴加适量银氨溶液,并用水浴将C加热,发生反应的化学方程式是 。
(4)在反应过程中,甲、乙两种装置中都需直接加热的仪器是_______(填A、B、C)
(5)实验开始时,先打开气球D的开关,直至实验结束。气球D的作用是 。
(6)从生成甲醛的产量来看,你认为两套装置中较好的是________(填“甲”或“乙”)
四、(本题包括2小题,共16分)
17. 已知![]() ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成:
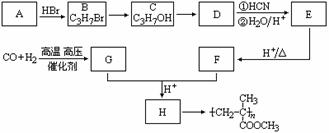
试写出:
⑴ A、E的结构简式分别为: 、 。
⑵ B→C、E→F的反应类型分别为: 、 。
⑶ 写出下列转化的化学方程式:C→D ;
G+F→H 。
18.丙烯酰胺是一种重要的有机合成的中间体。它的球棍模型如下图所示:(图中“棍”代表单键或双键或三健,不同颜色球表示不同原子:C、H、O、N)
(1)丙烯酰胺的分子式为 ,结构简式为 。
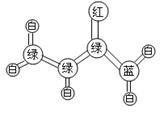 (2)有关丙烯酰胺的说法正确的是
(2)有关丙烯酰胺的说法正确的是
A.丙烯酰胺分子内所有原子不可能在同一平面内
B.丙烯酰胺属于烃的含氧衍生物
C.丙烯酰胺能够使酸性高锰酸钾溶液褪色
D.丙烯酰胺能够使溴的四氯化碳溶液褪色
(3)工业上生产丙烯酰胺的方法之一是(反应均在一定条件下进行):
![]()
反应Ⅰ和反应Ⅱ都是原子利用率100%的反应,反应Ⅰ所需另一反应物的分子式为 ,反应Ⅱ的方程式为 。
(4)聚丙烯酰胺(PAM)是一种合成有机高分子絮凝剂,写出由丙烯酰胺合成聚丙烯酰胺的化学方程式 。
五、(本题包括1小题,共16分)
19.相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
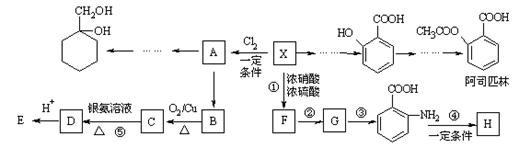
已知:
Ⅰ ![]()
Ⅱ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
⑴H的结构简式是______________;
⑵反应②的类型是 ___ ___ ;
⑶反应⑤的化学方程式是_________________;
⑷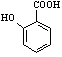 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有____种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有____种;
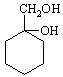
⑸请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 最合理的方案(不超过4步),请在答题纸的方框中表示。
最合理的方案(不超过4步),请在答题纸的方框中表示。
![]() 例:
例:![]()
六、(本题包括1小题,共12分)
20. 常温下一种烷烃A和一种单烯烃B组成混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将该混合气体1L充分燃烧在同温、同压下得2.5L CO2,试推断原混合气体中A和B所有可能的组合及其体积比。
(2)120℃时取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定混合气中各成分的分子式。
七、(本题包括1小题,共12分)
21.过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
 Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是
。
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是
。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
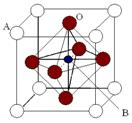
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式: 。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。(用含x的代数式表示)
 ⑶Mn的核外电子排布式为:
。
⑶Mn的核外电子排布式为:
。
⑷下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如右图:
![]() 08届市二模热身试题
08届市二模热身试题
化学答题纸
第Ⅰ卷(共48分)
一、二、选择题(1—14题)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 |
| |
| 答案 |
|
|
|
|
|
|
| |
第Ⅱ卷(共72分)
三、(本题包括2小题,共16分)
15.
(1)
(2)
(3)
(4)
16.
(1)________; ___________________ ;
(2)____ ____;
(3) ;
(4)__ __;
(5) ;
(6)_____ ___。
四、(本题包括2小题,共16分)
17.
⑴ 、 。
⑵ 、 。
⑶C→D ;
G+F→H 。
18.(1) , 。
(2) ,
(3) , 。
(4) 。
五、(本题包括1小题,共16分)
19.
⑴______________; ⑵___ ___ ;
⑶_________________ ;⑷__ __;
⑸
六、(本题包括1小题,共12分)
20.(1)
(2)

七、(本题包括1小题,共12分)
21.
Ⅰ、 。
Ⅱ、
⑴ 。
 ⑵
。(用含x的代数式表示)
⑵
。(用含x的代数式表示)
⑶ 。
⑷ 。
08届市二模热身试题
化学参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | C | B | D | B | C | D | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | ||
| 答案 | B | BD | BD | C | C | CD |
三、(本题包括2小题,共16分)
15.酸式滴定管(1分) a,b(1分),b,a(1分) 3.6mg·m-3(2分);是(1分)
注射器压送气体速度过快、装置气密性较差、导气管伸入KMnO4溶液中太浅、同一地点取样次数太多(3分)
可增大气体与溶液的接触面积,使空气中的HCHO被充分吸收(2分) 521次(2分)
16.(1)空气(或O2) 2CH3OH+O2 2HCHO+2H2O (2)CuO(或Ag2O)
(3)HCHO+4[Ag(NH3)2]OH
![]() 4Ag↓+CO2↑+8NH3↑+3H2O
4Ag↓+CO2↑+8NH3↑+3H2O
(4) A、B (5)实验过程中贮存气体,缓冲气流,实验结束时防止液体倒吸 (6)甲
四、(本题包括2小题,共16分)
17. (1)CH2=CHCH3、(CH3)2C(OH)COOH (各2分)(2)取代、消去 (各2分)
(3)2CH3CH(OH)CH3+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O
CH3OH+CH2=C(CH3)COOH
![]() CH2=C(CH3)COOCH3+H2O (各3分, 没写H2O不得分)
CH2=C(CH3)COOCH3+H2O (各3分, 没写H2O不得分)
18.(1)C3H5ON2 (1分) CH2=CH—C—NH2(2分) (2)ACD(2分)
(3)HCN(1分); CH2=CH—CN + H2O CH2=CH—C—NH2(2分)
(4)nCH2=CH—C—NH2 [ CH2—CH ] (2分)
五、(本题包括1小题,共16分)
19.⑴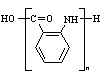 ⑵氧化反应 ⑶
⑵氧化反应 ⑶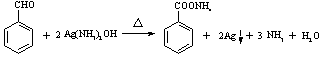 ⑷6 ⑸
⑷6 ⑸
(合成反应流程图4分,其他每空2分,共12分)
六、(本题包括1小题,共12分)
20. (1)设混合气体平均分子组成为CxHy
依据题意 CxHy~XCO2
1L xL
1L 2.5L x = 2.5
∴n(![]() ) = 2.5(mol) C2.5Hy
) = 2.5(mol) C2.5Hy
| 组合编号 | A的分子式 | B的分子式 | A和B的体积比(VA∶VB) |
| (1) | CH4 | C3H6 | 1∶3 ( |
| (2) | CH4 | C4H8 | 1∶1 ( |
| (3) | C2H6 | C3H6 | 1∶1 ( |
| (4) | C2H6 | C4H8 | 3∶1 ( |
(2) C2.5Hy + (2.5 + ![]() )O2
)O2![]() 2.5O2 +
2.5O2 + ![]() H2O(气)
H2O(气) ![]() V增加
V增加
1L ![]() (L)
(L)
1L (1 + 9)×6.25%(L)
![]() y
= 6.5
y
= 6.5 ![]()
∴C2.5H6.5 ![]()
按![]() 分别计算各组分的体积比(物质的量比)
分别计算各组分的体积比(物质的量比)
![]()
∴此组合不正确(∵按![]() 计算各组分物质的量比不一致 )
计算各组分物质的量比不一致 )
![]() ∴分子式为C2H6 B分子式C4H8
∴分子式为C2H6 B分子式C4H8
七、选做题(12分)
21.I、 ABCD(4分,每选对1个给1分)Ⅱ、(1)ABO3(2)(1-x)/x(3)[Ar]3d54s2(4)AC(8分,每空均2分)。