高三冲刺综合训练二
可能用到的相对原子质量:H-1 C-12 N-14 O—16 Na-23 S-32
Cl-35.5 Cu-64
第Ⅰ卷 选择题(共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有1个选项符合题意)
1、2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“水利发展与和谐社会”。下列有关活动中,不符合这一主题的是
A、大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放
B、大力推广使用纯净水代替自来水作生活用水,以保障用水安全
C、加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D、加强工业用水净化系统工程的改造,提高水的重复利用率
2、金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法中,错误的是
A、合金的性质与其成分金属的性质不完全相同
B、金属冶炼的本质是金属阳离子得到电子变成金属原子
C、工业上金属Mg、Al都是用电解熔融氯化物制得的
D、金属越活泼越难冶炼
3、下列说法中,正确的是
A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B、Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
C、SO2和HClO都具有漂白作用,且漂白的化学原理相同
D、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
4、下列叙述中,正确的是
![]() A、聚丙烯的结构简式为
A、聚丙烯的结构简式为
B、石英的化学式为CaSiO3
C、在CS2、PCl3中,各原子最外层均达到8电子稳定结构
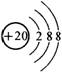 D、Ar原子的结构示意图为
D、Ar原子的结构示意图为
5、下列实验基本操作中,正确的是
A、过滤时,玻璃棒靠在三层滤纸边沿稍下方
B、配制一定物质的量浓度的溶液,在移液时玻璃棒轻靠在容量瓶瓶口
C、测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液
D、用托盘天平称取12.8 g干燥的NaOH固体时,各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
6、1 mol物质中含有的粒子数约为6.02×1023。下列叙述中,正确的是
A、室温下,22.4 L乙烷和乙烯的混合气体中含有的C原子数约为6.02×1023
B、标准状况下,11.2 LCCl4含有的分子数约为0.5×6.02×1023
C、常温常压下,17 gH2O2中含有的中子数约为8× 6.02×1023
D、0.5 L 0.5 mol·L-1NaNO3溶液中含有的粒子总数约为0.5×6.02×1023
7、X、Y、Z、W为四种短周期主族元素。其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法中,正确的是
A、X与W可以形成W2X、W2X2两种化合物
B、Y元素最高价氧化物对应水化物的化学式为H2YO4
C、原子序数由小到大的顺序为W<X<Y<Z
D、Y、Z两元素的简单离子的半径Y>Z
8、某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
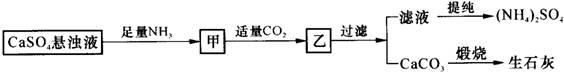 |
下列推断中,不合理的是
A、CO2可被循环使用
B、高温蒸干滤液能得到纯净的(NH4)2SO4
C、生成1 mol(NH4)2SO4至少消耗2 molNH3
D、向甲中通CO2有利于(NH4)2SO4生成
二、选择题(本题包括6小题,每小题4分,共24分。每小题有1~2个选项符合题意)
9、在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断中,错误的是
A、氧化性:ClO->I2>SO42-
B、漂白粉溶液可使淀粉碘化钾试纸变蓝
C、向氯水中加入亚硫酸钠溶液,氯水褪色
D、次氯酸钠可以与亚硫酸钠溶液共存
10、下列离子方程式中,正确的是
A、碳酸钠的水解反应:CO32-+2H2O=CO2↑+2OH-
B、亚硫酸氢铵和氢氧化钠的反应:NH4++OH-=NH3↑+H2O
C、溴化亚铁溶液和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D、碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
11、将等物质的量的X、Y气体充入一密闭容器中,在一定条件下发生如下反应并达平衡:X(g)+Y(g)![]()
![]() 2Z(g) △H<0。当改变某一个条件并达到新平衡后,下列叙述正确的是
2Z(g) △H<0。当改变某一个条件并达到新平衡后,下列叙述正确的是
A、升高温度,X的体积分数增大 B、增大压强,Z的浓度不变
C、保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D、保持容器体积不变,充入一定量的Z,X的体积分数增大
12、在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如下:
| AgCl | AgI | Ag2S | |
| Ksp(单位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述中,错误的是
A、沉淀转化的实质就是沉淀溶解平衡的移动
B、溶解度小的沉淀可以转化为溶解度更小的沉淀
C、AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D、25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
13、有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实中,不能说明上述观点的是
A、苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B、乙烯能发生加成反应,乙烷不能发生加成反应
C、甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色
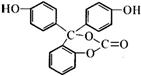 D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
14、某有机物的结构简式为 。1 mol该有机物与足量的NaOH
溶液充分反应,消耗NaOH的量为
A、2mol B、3 mol C、5 mol D、6mol
第Ⅱ卷 (非选择题 共72分)
三、(本题包括3小题,共26分)
15、(8分)中学化学中几种常见物质的转化关系如下:
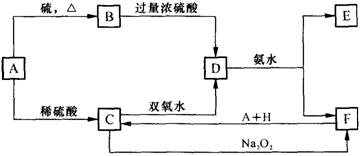 |
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
⑴红褐色胶体F粒子直径大小的范围: 。
⑵写出B、H的化学式:B ,H 。
⑶①H2O2分子的电子式是 。
②写出C的酸性溶液与双氧水反应的离子方程式:
。
⑷写出鉴定E中阳离子的实验方法和现象:
。
16、(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为NH3+CO2+H2O=NH4HCO3、
NH4HCO3+NaCl=NaHCO3↓+NH4Cl、2NaHCO3![]()
![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
⑴碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a、碳酸氢钠难溶于水 b、碳酸氢钠受热易分解
c、碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
⑵某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置 如下图所示(图中夹持、固定用的仪器未画出)。
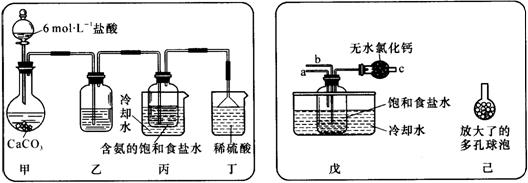 |
试回答下列有关问题:
(I)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
②另一位同学用图中戊装置(其他装置未画出)进行实验。
(I)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
。
17、(8分)下列关系图中,A是一种正盐,B是气态氢化物,C是氧化物,E是强酸。当X无论是强酸还是强碱时,都有如下转化关系(其他产物及反应所需条件均已略去)。
用化学式填写下列空格:
⑴A是 。
⑵当X是强酸时,A、B、C、D、E均含有同一种元素,E是 。
⑶当X是强碱时,A、B、C、D、E均含有同一种元素,E是 。
写出B→C反应的化学方程式: 。
四、(本题包括2小题,共24分)
18、(12分)⑴到目前为止,由化学能转变成热能或电能仍然是人类使用最主要的能源。
①化学反应中放出的热量(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol-1
E(H—H)=436 kJ·mol-1,E(Cl-Cl)=247 kJ·mol-1
则E(H—Cl)= 。
②已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
;
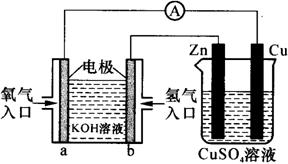 ③有右图所示的装置:
③有右图所示的装置:
该装置中Cu极为 极;当铜片
的质量变化为12.8 g时,a极上消
耗的O2在标准状况下的体积为
L。
⑵合成氨是人类科学技术发展史上的
一项重大突破,解决了地球上因粮
食不足而导致的饥饿与死亡。
①合成氨反应的热化学方程式如下:
N2(g)+3H2(g)![]()
![]() 2NH3(g) △H=-92.4
kJ·mol-1。为了提高NH3的产率,应如何选择反应条件?
。
2NH3(g) △H=-92.4
kJ·mol-1。为了提高NH3的产率,应如何选择反应条件?
。
②在一恒容的密闭容器中,以体积比l:3通入氮氢混合气体,使N2的物质的量浓度为a mol·L-1。在一定条件下发生反应,经t s后达到化学平衡,混合气体中NH3的物质的量浓度为b mol·L-1。则从反应开始至达到化学平衡时,H2的平均反应速率为 ,该条件下反应的平衡常数K= (用含a、b的函数式表示,不必化简)。
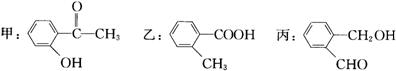 19、(12分)⑴今有化合物
19、(12分)⑴今有化合物
①请写出丙中含氧官能团的名称: 。
②请判别上述哪些化合物互为同分异构体: 。
③请按酸性由强至弱排列甲、乙、丙的顺序: 。
⑵由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
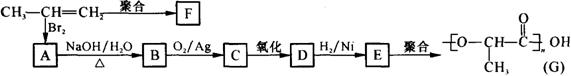 |
①丙烯分子中,最多有 个原子在同一个平面上。
②写出聚合物F的结构简式: 。
③写出B转化为C的化学方程式: 。
④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合
物的结构简式是 。
五、(本题包括1小题,共10分)
20、将3.20 gCu溶于30.0 mLb mol·L-1过量的硝酸溶液中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩溶液加水稀释至1 000 mL,测得c(NO3-)= 0.200 mol·L-1。
⑴试求稀释后溶液的pH。
⑵生成的气体中NO2和NO的物质的量(可用含有b的代数式表示)。
⑶用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO+NO2+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论b的取值范围。
六、(物质结构与性质,12分)
2l、⑴碳是形成化合物最多的元素,其单质与化合物广布于自然界。碳原子的核外电子排布式为 。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是 。
 ⑵CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2 互为等电子体的物质的化学式
。
⑵CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2 互为等电子体的物质的化学式
。
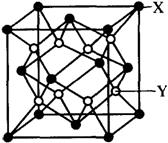
⑶某离子晶体的晶胞结构如右图所示。晶体中每一个
Y同时吸引着 个X。该晶体的化学式是 。
晶体中在每个X周围与它最接近且距离相等的X共
有 个。
⑷现有含Ti3+的绿色晶体,化学式为[TiCl(H2O)5]Cl2·H2O,是配位数为6的配合物。配离子[TiCl(H2O)5] 2+中含有的化学键类型是 ,该配合物的配体是 。
高三冲刺综合训练二答卷
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|
|
|
|
|
|
|
|
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
|
|
|
|
|
|
|
|
三、
15、⑴ ;⑵ , ;
⑶① ,② ;
⑷
。
16、⑴ ;⑵①Ⅰ ,Ⅱ ,
Ⅲ ,②Ⅰ , , , ;
Ⅱ 。
17、⑴ ;⑵ ;⑶ ;
。
18、⑴① ,② ,
③ , ;
⑵① ;
② , 。
19、⑴① ,② ,③ ;
⑵① ,② ,
③ ;
④ 。
20、
21、⑴ , ;
⑵ , ;⑶ , , ;
⑷ , 。
高三冲刺综合训练二答案
 | |||