08届高三化学上册第三次调研考试试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 CL35.5 Fe 56 Cu 64
第Ⅰ卷(选择题,共57分)
一、单项选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1、许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝 C、烧碱、氢气 D、食盐、淡水
2.关于胶体的叙述中不正确的是
A.长江三角洲的形成与胶体有关 B.不同的墨水不能混用
C. 胶体能够发生丁达尔现象,乳浊液也能发生 D. Fe3+的净水作用与胶体有关
3.下列叙述正确的是
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加的反应一定是氧化还原反应
C.有单质参加的化合反应一定是氧化还原反应
D.失电子难的原子,容易获得的电子
4.在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是
A.用量筒量取浓盐酸时俯视读数 B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线
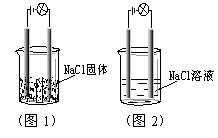 5.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
5.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
6.已知NaClO3 + 6HCl == NaCl + 3Cl2 + 3H2O,则氧化产物和还原产物的质量比是
A 6:1 B 5:1 C 3:1 D 2:1
7. ![]() U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关
U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关![]() U说法正确的是
U说法正确的是
A
![]() U原子核中含有92个中子 B
U原子核中含有92个中子 B ![]() U原子核外有143个电子
U原子核外有143个电子
C ![]() U与
U与![]() U互为同位素 D 23592U与
U互为同位素 D 23592U与![]() U互为同素异形体
U互为同素异形体
8.下列离子方程式中正确的是
A.硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+ ==BaSO4↓
B. 用大理石与盐酸制取CO2:CO32-+2H+ H2O+CO2↑
C.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO 32-
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
HCO3- + Ba2+ + OH-== BaCO3↓ + H2O
9.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
10.从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.①②③步骤的目的是从海水中提取MgCl2
C.提取镁的过程中涉及化合、分解、复分解反应 D.第④步电解时阴极产生氯气
二、不定项选择题(本题包括9小题,每小题3分,共27分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,
只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
11.设NA代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L水所含分子数为 NA
D.标准状况下,22。4LH2和O2的混合气体所含分子数为 NA
12.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同质量、不同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
13.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
14.已知 I—、Fe2+、SO 2、Cl—和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为
Cl—< Fe 2+< H2O 2 < I—< SO 2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42—+4H+ B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+H2SO4=SO2+O2+2H2O D.2Fe2++I2=2Fe3++2I—
15.氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
(A)HI和HClO (B)HCl和HIO (C)HClO3和HIO (D)HClO和HIO
16.R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是:
A.1 B.2 C.3 D.4
17.下列各组离子,在强碱性溶液中可以大量共存的是
A.K+、Na+、HSO![]() 、Cl- B.Na+、Ba2+、AlO
、Cl- B.Na+、Ba2+、AlO![]() 、NO
、NO![]()
C. Na+、K+、Cl-、NO![]() D.K+、Na+、ClO-、S2-
D.K+、Na+、ClO-、S2-
18. 下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
19.为除去混在氯化钾中的少量硫酸钾和氯化钙杂质, 需进行下列六项操作:
①加水溶解②加热蒸发结晶③加入过量氯化钡溶液④加入过量盐酸
⑤加入过量碳酸钾溶液⑥过滤, 下列操作顺序正确的是 ( )
A. ①③⑤⑥④② B. ①⑤③④⑥② C. ①③④⑥⑤② D. ①⑤③⑥④②
第Ⅱ卷(非选择题,共63分)
三、(本题包括2小题,共20分)
20.(8分)根据交叉分类法,请用斜线将下面框图的物质与它的分类连接起来:
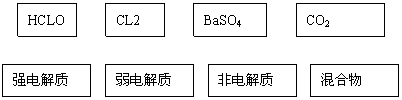 |
21.(12分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可表述为:
aKClO3 +bHCl(浓)——cKCl +dClO2 +eCl2↑ + fH2O
⑴、浓盐酸在反应中显示出来的性质 、 ;还原产物为 。
⑵、根据Cl元素守恒得a、b、c、d、e的关系式为 。
⑶、产生2mol ClO2 ,则转移的电子的物质的量为____________ mol 。
⑷、写出该反应的离子方程式____________ _______。
四、(本题包括1小题,共12分)
21.(12分)用![]() 的硫酸配制
的硫酸配制![]() 硫酸,若实验仪器有:
硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.20mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的是(填入编号)_________________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)___________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.
(3)怎样检查容量瓶是否漏水 。
五、推断题(本题包括2小题,共22分)
22.(12分)中学化学中几种常见物质的转化关系如下:
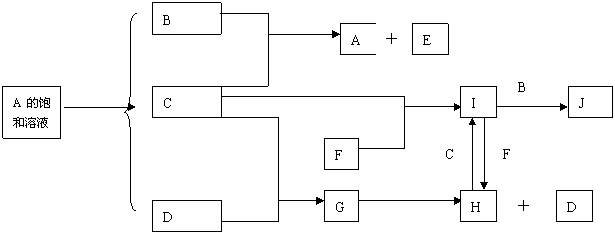

C,D为常见的气体单质,C为黄绿色,D为无色气体。F为一种常用的金属单质,J是一种红褐色的沉淀,反应①是重要的化工生产中的反应。 E的焰色反应为黄色。
将I溶液滴入沸水中可得到以J为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体J粒子直径大小的范围: 。
(2)A、B 、C、 F、H的化学式:A ,B ,C------,F----------,H
(3)①写出反应①的离子方程式: 。
②写出反应I→J的离子方程式: 。
(4)写出鉴定I中阳离子的实验方法和现象:
23、(10分)A、B、C、D四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、、CO32-中的一种。
⑴若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
⑵若向⑴的四支试管中分别加入盐酸,B盐溶液有沉淀生成,D盐溶液有五色无味的气体逸出。根据⑴、⑵实验事实可推断它们的化学式为:
A B C D 。
写出盐酸与D反应的离子反应方程式: 。
七、计算题(本题包括1小题,共7分)
24.标况下,1L水中可溶解448L的HCL,所得溶液的密度为1。2 g∕ml,,求所得溶液的物质的量的浓度?
化学答卷纸
可能用到的相对原子质量:H 1 C 12 N 14 O 16 CL35.5 Fe 56 Cu 64
一、二、选择题(每小题3分,共57分。1--10每小题有一个答案。11—19每小题有一个或二个正确答案,多选时,该题为0分;若正确答案包括两个选项, 只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | C | C | C | B | C | D | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| 答案 | D | AC | D | CD | B | B | BC | C | A |
三、(本题包括2小题,共20分)
20.(8分)根据交叉分类法,请用斜线将下面框图的物质与它的分类连接起来:
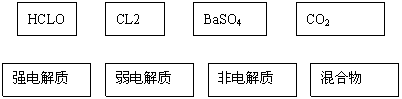 |
21.(12分)
⑴、浓盐酸在反应中显示出来的性质 酸性 、 还原性 ;还原产物为 CLO2 。
⑵、根据Cl元素守恒得a、b、c、d、e的关系式为 A+B=C+D+2E 。
⑶、产生2mol ClO2 ,则转移的电子的物质的量为__2__________ mol 。
⑷、写出该反应的离子方程式____________ _______。
四、(本题包括1小题,共12分)
(1)实验时应选用仪器的是(填入编号)__DCHGF_______________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)_BDC__________________。
(3)怎样检查容量瓶是否漏水
。
五、推断题(本题包括2小题,共22分)
22.(12分)
(1)红褐色胶体J粒子直径大小的范围: 1-100纳米 。
(2)A、B 、C、 F、H的化学式:A NaCL ,B NaOH ,C—CL2 ,F Fe H FeCI3
(3)①写出反应①的离子方程式: 。
②写出反应I→H的离子方程式:
(4)写出鉴定I中阳离子的实验方法和现象:
23、(10分)
写出化学式A BaCL2 B AgNO3 C CuSO4 D Na2CO3 。
写出盐酸与D反应的离子反应方程式: 。
六、计算题(本题包括1小题,共7分)