08届高三化学上学期八月月考试卷
Ⅰ(八月份)
化学试卷 命题人:徐殿东 王新南
审核人:王新南
说明:1、本试卷满分120分,考试时间100分钟。
2、可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ca 40
S 32 Na 23 K 39 Cu 64 Ba 137
第Ⅰ卷(选择题,共56分)
一、选择题(每小题只有一个选项符合题意。每小题3分,共8×3=24分。)
1.请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A.几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B.用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C.一定条件下,金属钠可以成为绝缘体
D.一定条件下,水在20℃时能凝固成固体
2.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.过氧化钠的结构式: Na-O-O-Na B.甲基的电子式:
C.K+ 离子的核外电子排布式:1s22s22p63s23p6 D.S原子的结构示意图为:![]()
3.下列有关物理量相应的单位表达错误的是
A.摩尔质量g/mol B.气体摩尔体积L/mol
C.溶解度g/100g D.密度g/cm3
4.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.2 mol钠与100 mL 1mol/L稀盐酸反应生成6.02×1023个H2分子
B.Na2O2与H2O反应生成1.12L O2,反应中转移的电子数为6.02×1023
C.0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1×6.02×1023个
D.1 L 1 mol/L Na2CO3溶液中所含的CO![]() 离子数目为6.02×1023
离子数目为6.02×1023
5.采用不同的分类方法,可将金属氧化物分为不同的类别。例如,从某种意义上讲,可将Na2O、CuO、MgO、Fe2O3等归为一类,则下列氧化物中与它们同属一类的是
A.Mn2O7 B.Na2O2 C.Al2O3 D.K2O
6.下列叙述正确的是
A.有单质参加或单质生成的化学反应一定是氧化还原反应
B.生成物只有一种的化学反应不一定是化合反应
C.溶于水后能电离出H+的化合物都是酸
D.有电解质参加的化学反应一定可以用离子方程式表示
7.下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 为确证NaHCO3固体中是否含Na2CO3 | 取少量待检固体溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
8.某溶液可能含有Na+、Ag+、Al3+、S2-、CO32-、SO32-、NO3―等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列结论中正确的是
A.此溶液中一定有S2-、SO32-、Na+
B.此溶液中一定有S2-、Na+、NO3-
C.此溶液中一定无Ag+、Al3+、NO3―
D.此溶液中一定有S2-、Na+,至少有SO32-或NO3―中的一种
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.下列叙述正确的是
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
10.根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是
I2+SO2+2H2O==H2SO4+2HI 2FeCl2+Cl2==2FeCl3 2FeCl3+2HI==2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
11.①氧化钠 ②氢氧化钠 ③过氧化钠 ④亚硫酸钠, 1mol上述固体物质长期放置于空气中,下列说法正确的是
A.上述物质都有发生了氧化还原反应
B.过氧化钠在反应中转移了2mol电子
C.质量增加的情况是①>③>④>②
D.质量增加的情况是②>①>③>④
12.14.2g69%的浓HNO3(密度为1.42g/cm3)与10mL 15.5mol/L HNO3的浓度相比
A.是同一浓度的不同表示方法 B.数值不同,也能换算为相同值
C.不同浓度的两种硝酸溶液 D.无法比较其大小
13.将钠或过氧化钠投入到氯化亚铁溶液中,可观察到的共同现象是
A.最终生成白色沉淀 B.最终生成红褐色沉淀
C.有气泡产生 D.无共同现象
14.下列反应的离子方程式书写不正确的是
A.少量金属钠加到冷水中:
Na+2H2O=Na++OH-+H2↑
B.用小苏打发酵制作馒头:
CH3CH(OH)COOH+HCO3-=CO2↑+H2O+CH3CH(OH)COO-
C.少量Na2O2固体加入到Na2SO3溶液中:
SO32-+Na2O2+ H2O =SO42-+2Na++ 2OH-
D.用过量石灰水对硬水软化:
Mg2++2HCO![]() +Ca2++2OH-==CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-==CaCO3↓+2H2O+MgCO3↓
15. 现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液
A.一定呈酸性 B.一定呈碱性
C.可能呈中性 D.一定呈中性
16.将9.58g Na2CO3 · 10H2O与 NaHCO3 的混合物溶于水配成100mL溶液,测得c(Na+)= 1mol·L—1。再取同质量的混合物,充分加热至质量不变时,所得固体的质量为
A.5.30 g B.7.78g C.6.72g D.2.86g
 08届高三月考试卷Ⅰ(八月份)
08届高三月考试卷Ⅰ(八月份)
第Ⅱ卷(非选择题,共64分)
请同学们把1~16答案填入下表:
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
三、(本题包括1小题,共13分)
17.X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答:
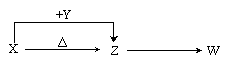
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
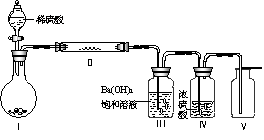
①装置Ⅰ中反应的化学方程式是 。
装置Ⅱ中物质的化学式是 。
②用Ⅹ含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要的装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
四、(本题包括2小题,共20分)
18.(6分)试回答下列中学化学实验中常见仪器的有关问题:
(1)在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平中,标有“0”刻度的是(填序号,下同) ;标有使用温度的仪器是 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器①试管、②分液漏斗、③细口试剂瓶、④广口试剂瓶、⑤集气瓶、⑥滴瓶、⑦酸式滴定管、⑧碱式滴定管中,用到 “磨砂”的有 。
19.现有下列8种物质,请按要求回答问题:
①淀粉溶胶 ②锌 ③氧化铁 ④碳 ⑤盐酸 ⑥苛性钠 ⑦碳酸钙
⑧氢氧化铜悬浊液
⑴(8分)运用树状分类法将这些物质(用化学式表示)进行分类。(要求分至最基本的类型,参看下图例示,将上述物质分类写在下图中)
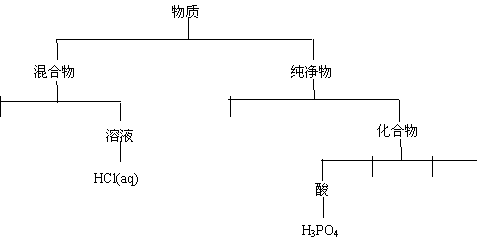 | |||
⑵(6分)常温下,上述物质两两混合,能够制取的气体有___________________,写出上述制取气体的有关的离子方程式,并注明反应类型(基本反应类型)
________________________________________________ ____________
________________________________________________ ____________
五、(本题包括2小题,共13分)
20.(7分)今有一混合物的水溶液,只可能含有以下离子中的若干种: NH4+ 、Cl-、Mg2+、Ba2+、K+、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验,并回答相关问题:
(Ⅰ)第一份加入AgNO3溶液有沉淀产生
(Ⅱ)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(Ⅲ)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
(1) 根据上述实验,以下推测正确的是 。
A.K+一定存在 B.该溶液中含CO32 -离子的浓度为0.1 mol/L
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
(2) 根据上述实验,该溶液中是否有不能肯定其存在的离子?若有,则为进一步确定其存在,应该补充的实验是________ _ _______
。
21.(6分)钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。另外,铷是比钾更活泼的金属,铷和氧反应生成更复杂的臭氧化铷(RbO3)。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3 = 6K2O+N2),39.0 g钾与10.1 g硝酸钾充分反应生成K2O的质量为__ g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 。
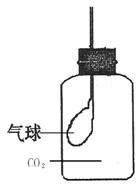 (3)K2O2、KO2、RbO3等均能与水或二氧化碳反应生成氧气,在医
(3)K2O2、KO2、RbO3等均能与水或二氧化碳反应生成氧气,在医
院、矿井、潜水、高空飞行中用作供氧剂。如图所示:集气瓶
中收集得到CO2,在瓶内有一只扎紧在玻璃管末端的气球。打
开塞子迅速往瓶里加入下列物质中的 (填序号),
立即塞紧塞子,过一会儿,气球会自动膨胀起来。
A.Na2O B.KO2 C.K2O2 D.RbO3
六、(本题包括1小题,共8分)
22.(8分)某强酸性反应体系中,反应物和生成物共六种物质:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2 →O2。
⑴该反应应选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
⑵该反应中发生还原反应的过程是: → 。
⑶写出该反应配平的离子方程式:
。
⑷如果上述反应中有6.72L(S.P.T.)气体生成,转移的电子数为 mol。
(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2+H2O = A + NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
七、(本题包括1小题,共10分)
23.(10分)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如下图所示,试回答下列问题:
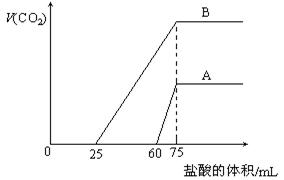 |
(1)原NaOH溶液的物质的量浓度为 。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是什么?其物质的量之比为多少?
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为 mL。
高三月考试卷Ⅰ(八月份)
参考答案
请同学们把1~16答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | C | C | A | D | B | C | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | D | C | AB | BC | AD | C | A |
第Ⅱ卷(非选择题,共64分)
三、(本题包括1小题,共13分)
17.(1)![]() (1分)
(1分)
(2)![]() (2分)
(2分)
(3)①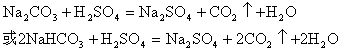 (2分) Na2O2(1分)
(2分) Na2O2(1分)
② H2O2 (1分) I、IV、V(2分)
(4)![]() (2分)
(2分)
四、(本题包括2小题,共20分)
18. (6分)(1)⑤⑧ ⑤⑥⑦ (2)②③④⑤⑥⑦
19.(1)(8分)
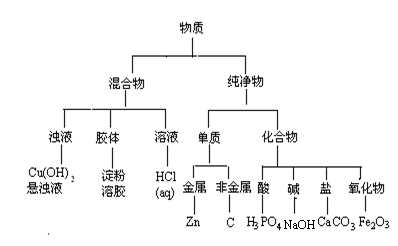
(2) H2和CO2(2分)
Zn + 2H+ = Zn2+ + H2↑ 置换反应,(1+1分)
CaCO3 +2H+ == Ca2+ +CO2↑+ H2O 复分解反应(1+1分)
五、(本题包括2小题,共13分)
20.(1)AC(4分)(2)取少量原溶液,加入足量Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3(3分)
21. (1)28.2 g(2分) (2)96.25%(2分) (3) AC(2分)
六、(本题包括1小题,共8分)
22.⑴ C (1分)
⑵ MnO4- → Mn2+ (1分)
⑶2MnO4- + 5H2O2 +6H+ → 2Mn2+ + 8H2O +5O2↑ (2分,未配平的扣1分)
⑷ 0.6 (2分)
(5)KHCO3(1分)H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性(1分)
七、(本题包括1小题,共10分)
23.(1) 0.75mol/L (2分)
(2)Na2CO3,NaOH ;(2分) 1:3 。(3分)
(3) 112 mL。(3分)