08届高三阶段测试卷
化学试题
一,选择题(每题只有一个选项符合题意,每小题3分,共48分)
1,金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法错误的是
A.合金的化学性质与成分金属不同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属腐蚀的本质是金属原子失去电子变成阳离子
D.若金属铁中混有金属锌,则能使铁不易发生电化学腐蚀
2,下列现象或应用不能用胶体知识解释的是
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐析出固体
C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D.水泥冶金厂常用高压电除去工厂烟尘,减少对空气污染
3.在实验室中,下列除去杂质的方法正确的是 A.硝基苯中混有浓HNO3和H2SO4,将其倒入到NaOH溶液中,静置,分液
B.乙烷中混有乙烯.通过氢气在一定条件下反应,使乙烯转化为乙烷
C..溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴
D.乙烯中混有SO2 ,通入溴水溶液中洗气
4,经检验,某酸雨的成分除含有少量H+和极少量OH-外,还有Na+、Cl-、NH+4、
SO2-4等离子,已知c(Na+)=7×10-6mol·L-1,c(Cl-)=3.5×10-5mol·L-1,c(NH+4)=2.3×10-5mol·L-1,c(SO2-4) =2.5×10-6 mol·L-1,则该酸雨的pH为
A.3 B.4 C.5 D.6
5,某学生欲完成反应2HCl+2Ag=2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是
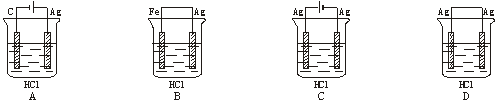
6,下列各组离子,在指定环境中一定能大量共存的是
A.pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B.加入铝粉能放出氢气的溶液中:CO32-、H+、I-、NO3-
C.由水电离出的c(H+)=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl-
D.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
7,设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,2.24L苯中含有碳原子数约为0.6NA
B.1L0.2mol/LNa2S溶液中含有的硫离子数为0.2NA
C.1molC20H42的分子中含有的共价键数目为61NA
D.5.6g铁粉与硝酸反应失去的电子数一定为0.3NA
8, 有机物 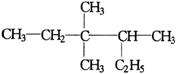 的正确命名为
的正确命名为
A.2-乙基-3,3-二甲基-4-乙基戊烷 B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基已烷 D.2,3,3-三甲基已烷
9,现有Mg、Al混合物粉末10.2克,将它溶解在500ml 4mol/L的盐酸中,若要使沉淀量达到最大值,则需要加入2mol/LNaOH溶液体积是
A.500ml B.1000ml C.2000ml D.不能确
10,在20 mL pH=2的醋酸溶液中,加入V mLpH=12的NaOH溶液。则下列说法正确的是
A.如果V=20,则所得混合溶液的pH大于7
B.当V=20时,混合溶液中离子浓度大小关系为:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.如果所得混合溶液的pH=7,则V小于20
D.所得混合溶液中一定存在c(Na+) + c(H+) = c(CH3COO-) + c(OH-)
11,下列说法正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-=Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.钢铁发生电化腐蚀的正极反应式:Fe-2e- =Fe2+
12,已知NaHSO4在水中的电离方程式为:NaHSO4
= Na+ + H+ + SO![]() 。某温度下, 向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下, 向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
13,工业上将苯的蒸气通过赤热的铁合成一种可作传热载体的化合物,该化合物分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6mol氢气,判断这种化合物可能是
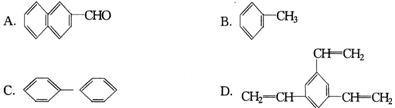
14,向容积为2 L的密闭容器中充人2
mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
15,下列离子方程式正确的是
A.FeS放入稀盐酸溶液中:FeS+2H+=Fe2++H2S↑
B.足量的氯气通入FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl-
C.向偏铝酸钠溶液中滴加过量的碳酸氢钠溶液:AlO2-+4H+=Al3++2H2O
D.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+
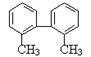 16,已知C-C可以绕键轴旋转,结构简式为
的烃,下列说法正确的是
16,已知C-C可以绕键轴旋转,结构简式为
的烃,下列说法正确的是
A.分子中至少有8个碳原子处于同一平面上
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯代物最多有4种
D.该烃是苯的同系物
08届高三阶段测试答题卡
一,选择题(共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二,填空题(本题有5小题,共33分)
17,(2分)在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是______________________________________(填序号)
①AlCl3 ②NaHCO3 ③MgSO4 ④KMnO4 ⑤Na2CO3 ⑥NH4Cl
18,(4分)某学生中和滴定实验的过程如下:(1)取一支碱式滴定管;(2)用蒸馏水洗净;(3)即加入待测的NaOH溶液;(4)记录液面刻度读数;(5)用酸式滴定管精确放出一定量标准酸液;(6)置于未经标准酸液润洗的洁净的锥形瓶中;(7)加入适量蒸馏水;(8)加入酚酞试液两滴;(9)滴定时,边滴边振荡;(10)边注视滴定管内液面的变化;(11)当小心滴到溶液由无色变为粉红色时,即停止滴定;(12)记录液面刻度读数;(13)根据滴定管的两次读数得出NaOH溶液体积为22mL,指出上述实验过程中错误之处(用序号表示) 。
19,(7分)某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答:
(1)烃A的分子式为_________。
(2)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有_________ g烃A参加了反应,燃烧时消耗标准状况下的氧气______L。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则此烃A的结构式为__________。
(4)若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物经测定,分子中含有4个甲基,烃A可能有的结构简式___________________________
20,(8分)称取三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上导管塞子,定时测定生成氢气的体积。甲加入50 mL pH=3的盐酸,乙加入50 mL pH=3的醋酸,丙加入50 mL pH=3的醋酸及少量胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌,请用“>”“=”或“<”回答:
(1)开始时反应速率的大小为________。
(2)三支试管中参加反应的锌的质量为________。
(3)反应终了,所需时间为________。
(4)在反应过程中,乙、丙速率不同的理由(简要说明)是
21,(12分)合金A由四种单质组成,经一系列反应后分别转化成沉淀或气体。
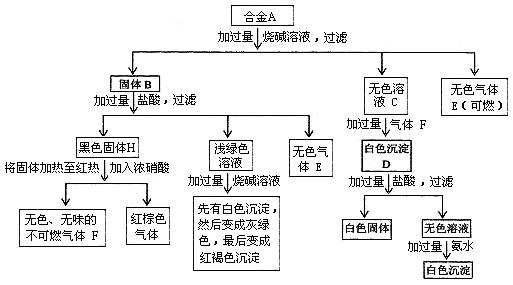
请回答下列问题:
(1)合金A由哪4种单质组成(写出化学式): _ 、 _ 、 _ 、 _ 。
(2)写出黑色固体H生成气体F的化学反应方程式
(3)写出合金A中有关组成与过量烧碱溶液反应的离子方程式:
(4)写出向无色溶液C通过量气体F生成白色沉淀D的有关反应的离子方程式:
三、实验题(本题有2小题,共19分)
22,(12分)有某种含有少量氯化亚铁杂质的FeCl3样品,现要测定其中铁元素的质量分数,实验采取以下步骤进行:
①准确称量m g样品(在2~3 g范围内)。
②向样品中加入10 mL 6 mol·L-1盐酸,再加入蒸馏水,配制250 mL溶液。
③量取25 mL操作②中配得的溶液,加入3 mL溴水,加热使反应完全。
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全。
⑤过滤,将沉淀洗涤、灼烧、冷却、称量,反复操作至恒量。
根据以上叙述,回答:
(1)在称量样品时,若称量前天平的指针偏向标尺左方,称量读数时,指针刚好在标尺中央,所得样品质量是____________(填编号)。
A.比m g多 B.比m g少 C.恰好m g
(2)溶解样品时要加入盐酸,原因是______________________。
(3)加入溴水后,发生反应的离子方程式为______________________。
(4)加入氨水要过量的原因是______________________________。
(5)检验沉淀是否洗涤干净的方法是______________________________
(6)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量为W2 g,则样品中铁元素的质量分数是______________________________。
23,(7分)实验室中利用电石和水反应制取一定量乙炔进行其性质实验(通入溴水、酸性KMnO4溶液),最后点燃(如图)。
回答下列问题:
①制取乙炔的化学方程式为 ;
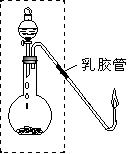 ②实验前,应检查气体发生装置(如图虚线框内装置)的气密
②实验前,应检查气体发生装置(如图虚线框内装置)的气密
性。某同学双手捂住烧瓶,把导气管伸入水面下,但无任何
气泡冒出,则出现此原因可能是 。
A.没有关闭分液漏斗的活塞
B.橡皮塞上的孔与导管不匹配或橡皮塞与分液漏斗不匹配
C.导管伸入水面下太深
D.烧瓶容积较大
③实验室用如图装置点燃乙炔,由于乙炔在空气中燃烧会产生浓烈的黑烟,所以在实验时点燃后要迅速熄灭火焰。试用一种简单的安全的操作方法熄灭火焰:
08届高三阶段测试参考答案
一,1B 2C 3A 4C 5C 6D 7C 8C
9B 10D 11A 12D 13C 14B 15A 16B
二,17, 3 5 18, 3 10 11 13
19,(1) C6H12 (2) 42,100.8 (3)
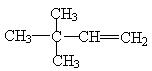
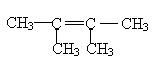 |
(4) 或
20,(1)甲=乙=丙 (2)甲=乙<丙 (3)甲>乙>丙(4)形成原电池后,作负极的活泼金属溶解速率加快,因此,乙和丙速率不同
21, (1)C 、 Fe 、 Al、 Si (各1分 ,共4分)
(2)![]()
(3)![]()
![]()
(4)![]() (各2分 )
(各2分 )
22, (1)B (2分)
(2)抑制Fe3+水解,以免溶解时产生浑浊(2分)
(3)2Fe2++Br2=2Fe3++2Br-(2分)
(4)使Fe3+完全转化为Fe(OH)3沉淀(2分)
(5) 取少量最后洗涤液,加入AgNO3溶液,若无沉淀产生,证明已洗涤干净(2分)
(6)![]() ×100%(2分)
×100%(2分)
23, ①CaC2+2H2O→Ca(OH)2+C2H2↑(2分) ②ABC (2分)
③用手指把连接导气管的乳胶管捏瘪一下,火焰自动熄灭 。(或:用湿的抹布轻轻覆盖住燃烧着的导气管口,火焰熄灭。)(3分)(其他合理答案也可,但不是简单、不合理或者不安全的熄灭方法不给分)。