08届高三化学 元素化合物期末训练题
(2)
班级 姓名
1.下列各组物质,只使用一种外加试剂(必要时可加热)即可给出鉴别的是 ( )
①FeS、CuS、MnO2、CuO四种黑色固体;②HCl、BaCl2、NaCl、NaOH四种无色溶液;
③NaCl、Na2CO3、NaAlO2、Na2SiO3四种无色溶液;④(NH4)2SO4、NaCl、K2SO4、NH4Cl 四种白色固体
A.只有①② B.只有③④ C.只有①②③ D.全部
2.下列图式正确的是( )
![]()
![]() A.氟化氢的电子式:
B.次氯酸的结构式: H-Cl-O
A.氟化氢的电子式:
B.次氯酸的结构式: H-Cl-O
![]() C.铝离子的结构示意图 D.氯化铯的晶体结构(晶胞)模型:
C.铝离子的结构示意图 D.氯化铯的晶体结构(晶胞)模型:
3.英国研究人员 2007 年 8 月 30 日发表报告认为,全球将有 1.4 亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡 24 小时后,其含砷量才能达到食用安全标准。下列对砷 ( As )的有关判断正确的是( )
A.砷原子序数为 33 ,它与铝为同主族 B.砷化氢的稳定性比溴化氢的强
C.砷酸的酸性比硫酸的弱 D.砷的原子半径小于磷的原子半径
4.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg + Mo3S4 ![]() MgxMo3S4
在镁原电池放电时,下列说法错误的是( )
MgxMo3S4
在镁原电池放电时,下列说法错误的是( )
A.Mo3S4发生氧化反应 B.正极反应为:Mo3S4 + 2xe- = Mo3S42x-
C.Mg2+向正极迁移 D.负极反应为:xMg - 2xe- = xMg2
5.下列反应①碳酸氢钙与NaOH溶液反应②苯酚钠溶液与二氧化碳反应③氯气与烧碱稀溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是与石灰水反应( )
A.①② B.①③ C.①④ D.②④
6.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中15molCuSO4氧化的P原子的物质的量为( )
A.3mol B.11mol C.6mol D.5mol
7.用惰性电极做NaCl水溶液导电性实验时,下列叙述正确的是( )
A.通电时,只有Na+向阴极移动,Cl-向阳极移动
B.阳极发生了氧化反应,生成了氯气,阴极发生了还原反应,生成了还原产物氢气
C.若在阴极附近的溶液中滴入酚酞溶液,溶液无什么变化
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
8.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO![]() )、c(HCO3¯)都减少,其方法是
)、c(HCO3¯)都减少,其方法是
A.加入饱和石灰水溶液 B.加水
C.通入二氧化碳气体 D.加入氢氧化钠固体
9.在120℃时,将质量均为m g的H2、CO、甲醛、甲酸甲酯完全燃烧,将生成的气体产物分别通过足量的固体过氧化钠干燥管,干燥管质量增加依次为:m1、、m2、m3、m4,则它们的关系正确的是:
A.m1 = m2 = m3 = m4 B.m1 > m2 > m3 > m4
C.m1 = m2 > m3 = m4 D.m1 < m2 < m3 < m4
10.下列说法正确的是(NA表示阿伏加德罗常数)( )
A.常温常压下,32g臭氧中所含的原子数为2NA
B.标准状况下,1L己烷完全燃烧可得到的CO2分子数为 6NA/22.4
C.3.2g铜丝在硫蒸气中完全燃烧,转移的电子数为0.1NA
D.31g白磷中含有NA个化学键
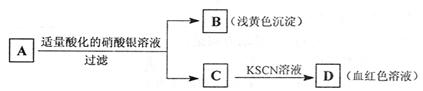
|
由此分析,下列结论中,正确的是( )
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
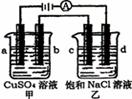 12.如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。下列说法正确的是 ( )
12.如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。下列说法正确的是 ( )
A.甲、乙两烧杯中溶液的pH均保持不变
B.乙烧杯中d的电极反应为2Cl—-2e—=Cl2↑
C.乙烧杯中通入适量HCl气体溶液组成可以恢复
D.a极产生1.12L(标况)气体时,c极产生2g气体
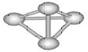 13.最近意大利罗马大学的FuNvio
Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
13.最近意大利罗马大学的FuNvio
Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.14N原子核内的中子数为7
C.N4沸点比P4(白磷)高 D.1molN4气体转变为N2吸收882kJ热量
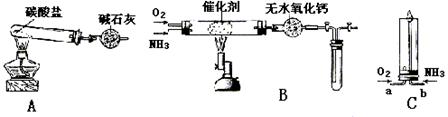
14.资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
|
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该反应的化学方程式是 ;
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 。
其理由是
②氨气燃烧的化学方程式是
![]() 15.工业上制备单质碘的方法之一是从碘酸盐开始的。第一步先用适量的亚硫酸氢盐将碘酸 盐还原成碘化物,离子方程为:IO3-+HSO3-
I-+SO42-+H+。第二步将第一步得到的酸性碘化物溶液再跟适量的碘酸盐溶液混合,发生反应析出了碘。试问:
15.工业上制备单质碘的方法之一是从碘酸盐开始的。第一步先用适量的亚硫酸氢盐将碘酸 盐还原成碘化物,离子方程为:IO3-+HSO3-
I-+SO42-+H+。第二步将第一步得到的酸性碘化物溶液再跟适量的碘酸盐溶液混合,发生反应析出了碘。试问:
(1)第二步发生反应的离子方程式是 。
(2)若要使碘酸盐的利用率最高,碘酸盐在第一步和第二步反应中的用量之比应为 。
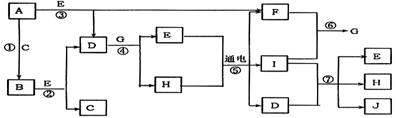
16. (11分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:
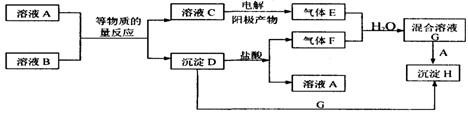
若E和F均为有刺激性气味的气体,H不溶于酸,请填写下列空白。
(1)气体E的化学式为 ,气体F的化学式为 ,C中溶质的化学式为 。
(2)写出下列反应的离子方程式:
C→E ;
D+G→H ;
(3)在混合溶液G中滴人几滴石蕊溶液,可见现象为 ,
原因是 。
|
(1)H的电子式 。
(2)反应⑦的离子方程式为 。
(3)向AlCl3溶液中逐渐加入过量D的反应方程式为 。
(4)写出反应②的化学方程式 。
(5)写出实验室制取I的离子方程式 。
18.(10分)当前,一次性筷子、一次性饭盒的安全已受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为使筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。
 (1)铅的元素符号是
,它在周期表中的位置是
。
(1)铅的元素符号是
,它在周期表中的位置是
。
(2)防止或减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,
减少二氧化硫的含量。
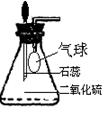
①为研究SO2的溶解性质,某学生做如下实验:如右图,锥形瓶中收集的是SO2,瓶塞系着瘪气球,气球与大气相通。向瓶中滴加紫色石蕊试液,实验现象: 。
②为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解度大于CO2在水中溶解度的实验现象是: 。
 ③某学生用试管取出上述①实验后的瓶中溶液适量,滴入少量品红溶液,充分振荡,实验现象为: ,接着向溶液加入足量氯水,实验现象为:
,再滴加BaCl2溶液,实验现象为:
。
③某学生用试管取出上述①实验后的瓶中溶液适量,滴入少量品红溶液,充分振荡,实验现象为: ,接着向溶液加入足量氯水,实验现象为:
,再滴加BaCl2溶液,实验现象为:
。
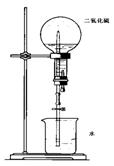
④有人利用SO2易溶于水的性质设计成如图所示的装置进行喷泉实验,但实验效果并不理想。为完成效果明显的喷泉实验,可将水改为 溶液。
(3)制一次性筷子有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥打磨,使筷子变得光滑,以免毛疵划人的口腔。已知滑石粉是一种含水的具有层状结构的硅酸盐矿物。其质量组成为MgO 31.88%,SiO2 63.37%,H2O 4.75%,其化学式为: 。
元素化合物(2)
14、①(NH4)2CO3[或NH4HCO3] ②吸收水和二氧化碳
(2)①4NH3+5O2![]() 4NO+6H2O 2NO+O2====2NO2
4NO+6H2O 2NO+O2====2NO2
②2NO2(气)![]() N2O4(气)+热量,降低温度使平衡正向移动,部分红棕色NO2转化为无色N2O4。
N2O4(气)+热量,降低温度使平衡正向移动,部分红棕色NO2转化为无色N2O4。
(3)①先通入O2,后通入NH3。若先通氨气,氨在空气中不能点燃,逸出造成污染。
②4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
15.(4分)IO3-+5I-+6H+=3I2+3H2O (2分)(注:不配平扣1分。) 5:1(2分)
16、(共11分)(1) Cl2, SO2, NaCl (各1分)
![]()
![]() (2分)
(2分)
(2分)(3)变红色(1分). A为BaCl2,B为Na2SO3,因A与B是等物质的量混合(Na2SO3+BaCl2
![]() 17.(共10分)
17.(共10分)
(1) (2分)
(2)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)AlCl3 + 4NaOH = NaAlO2 + 2H2O+3NaCl (2分)
(4)2Na2O2+2H2O=4NaOH+O2↑(2分)
(5)MnO2 + 4H++2Cl- =Mn2+ + 2H2O +Cl2↑ (2分)
18.(10分)(1)Pb(1分) 第六周期ⅣA族(1分)
(2)①紫色石蕊试液变红、气球鼓胀起来(1分)。
② SO2溶解时气球鼓胀的程度大于CO2溶解时气球的鼓胀程度(1分)。
③品红溶液的红色褪去,溶液显浅紫色(1分)。
先变红后褪色(1分)。
生成白色沉淀(1分)。
④ NaOH等强碱 (1分)
(3)Mg3(Si4O10)(OH)2或3Mg O·4SiO2·H2O(2分)