08届高三化学12月月考试卷
寄语:细节决定成败,慎思体现素质,规范凸现成绩
第Ⅰ卷 选择题 (共70分)
一. 选择题(本题包括10小题,每小题3分,共30分。每小题只有1个选项符合题意)
1.2008年将在我国北京举行夏季奥运会,这次奥运会提出要突出“绿色奥运、科技奥运、人文奥运”的理念,其中绿色奥运是指( )
A.运动员的食品全部是未加任何添加剂的食品
B.所有奥运用品全部是天然绿色植物
C.奥运场馆建设均使用天然材料建造,不使用人工合成材料
D.把环境保护作为奥运设施规划和建设的首要条件
2.在常温常压下呈气态的化合物,降温使其变成固体,得到的晶体属于( )
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
![]()
 3.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
3.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
A 铅笔端作阳极,发生还原反应
B 铂片端作阴极,发生氧化反应
C 铅笔端有少量的氯气产生
D a点是负极,b点是正极
4.如图所示为在一定条件下进行的可逆反应,当改变其中一个条件时的图象变化曲线。则图象表示的可逆反应为( )
A.N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.H2+I2![]() 2HI(g) ΔH<0
2HI(g) ΔH<0
C.C(s)+H2O(g)![]() CO(g)+H2(g)ΔH>0
CO(g)+H2(g)ΔH>0
D.H2S(g)![]() S(s)+H2(g)ΔH>0
S(s)+H2(g)ΔH>0
5.类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的。不能违背客观实际。下列各说法中,正确的是
A.HCl的水溶液呈强酸性,HF的水溶液也呈强酸性
B.CH4是正四面体结构,SiH4也是正四面体结构
C.O2与Cu反应生成CuO,S与Cu反应生成CuS
D.CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2
6.下列实验方案中,不可行的是
A.用加入足量铜粉的方法除去Cu(NO3)2 溶液中混有的AgNO3
B.用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
C.加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,确定溶液中有NH4+
D.先后添加石蕊试液、BaCl2 溶液,将盐酸、硫酸、硫酸钠、氢氧化钠四种无色溶液鉴别开
7.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:
![]() 2KClO3 +
H2C2O4 +
H2SO4 2ClO2↑+ K2SO4 +
2CO2↑+ 2H2O
2KClO3 +
H2C2O4 +
H2SO4 2ClO2↑+ K2SO4 +
2CO2↑+ 2H2O
下列说法正确的是
A.KClO3在反应中得到电子 B.ClO2 是氧化产物
C.H2C2O4在反应中被还原
D.1 mol KClO3 参加反应有 2 mol 电子转移
8.通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是
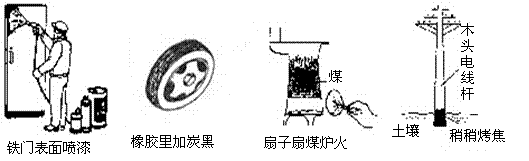 |
A B C D
A B C D
9、磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将:FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,
即可生成黑色的分散质粒子直径在5.5~36 nm的磁流体。下列说法中,正确的是 A.所得的分散系属于溶液
B.所得的分散系中分散质为Fe2O3
C.当一束强可见光通过该分散系会出现光亮的通路
D.该分散系不属于介稳体系
10.过氧化氢(H2O2)熟称双氧水,它是一种液体,易分解为水和氧气,常用作氧化剂、漂白剂和消毒剂。为了贮存、运输、使用的方便,工业上采用“醇析法”:将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠失效的是
A.MnO2 B.Na2SO3溶液 C.稀盐酸 D.CH3COONa溶液
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
11..短周期元家W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族.W 与X 可形成共价化合物WX2 ,Y原子的内层电子总数是其最外层电子数的2.5 倍。 下列叙述中不正确的是
A.WX2分子中所有原子最外层都为8 电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X <W<Y<Z
12.用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.T℃时,1 L pH=6纯水中,含10—6NA个OH—
B.6.8 g熔融的KHSO4中含有6.02×1022个阳离子
C.23.4 g NaCl晶体中含有6.02×1022个右图所示的结构单元
D.用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1 NA
13.花青苷是引起花果呈现颜色的一种花色素,广泛存在于植 物中。它的主要结构在不同pH条件下有以下存在形式:
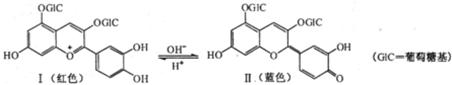
下列有关花青苷说法不正确的是
A.花青苷可作为一种酸碱指示剂
B.I和Ⅱ中均含有二个苯环
C.I和Ⅱ中除了葡萄糖基外,所有碳原子可能共平面
D.I和Ⅱ均能与FeCl3溶液发生显色反应
14.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
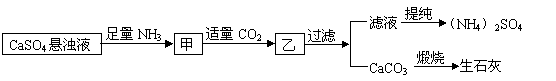 |
下列推断不合理的是
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用
D.往甲中通CO2有利于(NH4)2SO4生成
15.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是( )
A、Fe3+、Na+、Cl-、S2ˉ (1︰2︰3︰1)
B、NH4+、Ba2+、OHˉ、Clˉ (1︰1︰1︰2)
C、K+、H+、Iˉ、HCO3ˉ ( 1︰1︰1︰1)
D、Na+、Al3+、Clˉ、OHˉ (5︰1︰4︰4)
16.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2CH3COONH4== (CH3COO)2 Pb +(NH4)2SO4。当在(CH3COO)2 Pb(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成,表示这个反应的有关离子方程式是
A.(CH3COO)2 Pb +H2S == PbS↓ + 2 CH3COOH
B.Pb2++H2S == PbS↓+2H+
C.Pb2++2CH3COO—+H2S == PbS ↓+2 CH3COOH
D.Pb2++2 CH3COO— + 2H+ + S2— == PbS↓+2 CH3COOH
17.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是
A.HCO3- 既是酸又是碱,NH3既不是酸又不是碱
B.ClO-+H2O![]() HClO+OH-不是酸碱反应
HClO+OH-不是酸碱反应
C.2Na+2H2O → 2NaOH+H2↑ 是酸碱反应
D.碱性强弱顺序为:C2H5O- > OH- > C6H5O-
18.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
| 现象 | 解释 | |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
19.将0.4 mol铁粉逐渐加入到含硝酸0.8 mol的稀硝酸中,反应生成气体的物质的量N随消耗铁粉的物质的量n变化关系正确的是( )
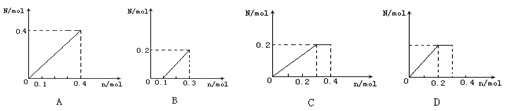
20.常温下,下列有关叙述正确的是
A.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L
B.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①>②>③
C. Na2CO3溶液中, c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液
体积V(总)≥20mL
|
三、(本题包括2小题,共29分)
21.(10分)某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失。大家经查阅资料后,发现可能的原因是发生了下列反应:AgI+I-![]() [AgI2]-。
[AgI2]-。
(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验。
实验1:向浓KI溶液中滴加AgNO3溶液,现象为 。
实验2:向AgNO3溶液中滴加稀KI溶液,有黄色沉淀生成;再
。
(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀。请解释出现沉淀的原因 。
(3)丙同学在实验所得的溶液中滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色。大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是 ;请设计简单的实验说明不会产生AgCl沉淀: 。
22.(8分) 补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol/L、0.008mol/L等一系列浓度的[Fe(SCN)6]3—(红色)标准比色液
 ②样品处理
②样品处理
③准确量取一定体积的待测液于溶液中(比色管),加入稍过量的KSCN溶液,并稀释到10mL。
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
①配制100mL0.01mol/L溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要: 、 。
②步骤②脱色过程包括加入: (填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→ (填操作)。
③比色法确定待测液的浓度其原理是
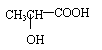 ④若其补铁剂是由乳酸(
)与铁粉作用生成的,请写出该反应的化学
④若其补铁剂是由乳酸(
)与铁粉作用生成的,请写出该反应的化学
方程式:
23. (11分) 在实验室可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
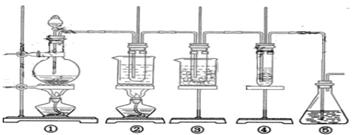
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。请填写下列空白:
( l )制取氯气时,在烧瓶里加人一定量的二氧化锰.通过_____________________(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有_____________________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
 ( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
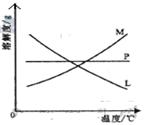
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_____________________(填写编号字母);
从②的试管中分离出该晶体的方法是__________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:___________________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为____色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________________________ |
| 然后溶液从无色逐渐变为____色 | _______________________________________________ |
四、(本题包括2小题,共22分)
24. (12分)1943年我国著名的化工专家侯德榜博士发明了联合制碱法,后被命名为侯氏制碱法。侯德榜制碱法原理与索尔维法基本相同,不同之处,在析出碳酸氢钠后的母液中继续加入食盐,通入氨气,使氯化铵析出,从而得到了两种物质:碳酸纳和氯化铵,侯氏制碱法震惊了全世界,为中国人赢得了荣誉和尊重。侯氏制碱法的循环工艺流程如下:
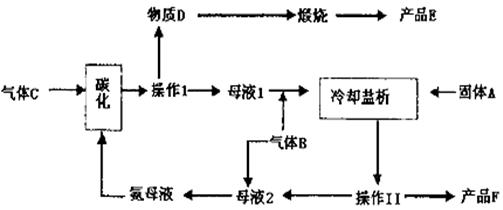
仔细阅读上图,完成下列问题:
(1) 写出碳化反应方程式: 。
| |
(3) 在下列方框内画出实验室中向饱和食盐水中
通入气体B的装置图。
(4) 操作Ⅰ的名称是 ,操作Ⅱ的
名称是 。进行操作Ⅱ所需要的玻璃仪
器是:玻棒、烧杯、 。在实验室里进
行煅烧所用的主要仪器是 。
(5) 上述生产过程中能循环使用的物质是:C、B、F、 、 。(填:物质编号)
25. (10分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
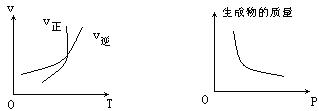
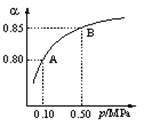 (1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)![]() 2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
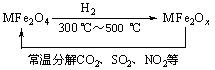
请写出MFe2Ox分解SO2的化学方程式______________________________________(不必配平)。
26. (10分)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4—、HPO42—、和PO43—四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
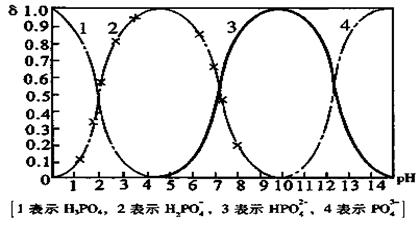
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
。
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 。当pH=7时,溶液中主要存在的阴离子(OH—离子除外)是 。
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 。
(4)在Na3PO4溶液中,c(Na+)/ c(PO43—) 3(填“>”、“==”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/ c(PO43—)的值减小,原因是 。
五、(本题包括1小题,共10分)
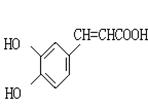
27.咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。

(1)咖啡酸中含氧官能团的名称为 。
(2)咖啡酸可以发生的反应是 (填写序号)。
①氧化反应 ②加成反应 ③酯化反应 ④加聚反应 ⑤消去反应
(3)咖啡酸可看作1,3,4一三取代苯,其中两个相同的官能团位于邻位,取
代基中不含支链。则咖啡酸的结构简式为 。
(4)3.6g咖啡酸与足量碳酸氢钠反应生成气体(标准状况) mL。
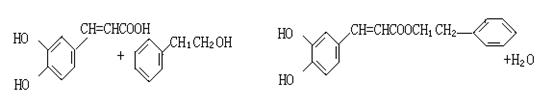
(5)蜂胶的主要活性成分为CPAE,分子式为C12H16O4,该物质在一定条件下
可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡跟该芳香醇在一定条件下反应生成CPAE的化学方程式为 。
六、选做题(本题包括2小题,每小题10分,考生只能选做一题。28小题为“有机化学基础”内容的试题,29题为“物质结构与性质”内容的试题)
考生注意:
28、29题为选做题,考生可任选一题。先在答题卡指定位置填写你所选择的试题号,再按要求答题,如果不填试题号,一律按0分计。28题适合选修《有机化学基础》模块的考生解答,29题适合选修《物质结构与性质》模块的考生解答。
28.仔细体会下列有机合成过程中碳骨架的构建及官能团的引入和转化,完成下题:
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
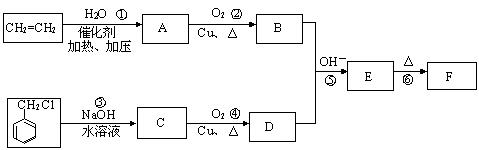
已知:反应⑤为羟醛缩合反应。请回答:
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)反应①~⑥中符合原子经济性的是 。
(3)写出下列转化的化学方程式:② ,③ 。
写出有关反应的类型:② ⑥ 。
(4)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
29.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子空间构型为 。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填“名称”);晶体ZW的熔点比晶体XW4明显高的原因是 。
(4)ZW晶体的结构示意图如下。已知:ρ(ZW)=2.2
g·cm-3,NA=6.02×1023 mol-1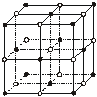 ,则ZW晶体中两个最近的Z离子中心间的距离为
,则ZW晶体中两个最近的Z离子中心间的距离为
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、(本题包括2小题,共29分)
21.(每空2分,共10分)
(1)没有沉淀生成 在所得的黄色沉淀中滴加浓KI溶液,黄色沉淀溶解
(2)加入硝酸溶液后,HNO3将I-氧化,使I-浓度减小,平衡AgI+I-![]() [AgI2]-逆向移动
[AgI2]-逆向移动
(3)AgI、AgCl的溶解度 在黄色的AgI沉淀中滴加NaCl溶液,沉淀未转化为白色
22. (8分) ⑴100mL容量瓶,胶头滴管;(各1分)⑵活性炭,过滤;(各1分)
⑶溶液颜色与物质的量浓度成正比(2分)
⑷2CH3CHOHCOOH+Fe → (CH3CHOHCOO)2Fe+H2 (2分)
23. (11分) ( l ) 分液漏斗(1分) B(1分)
(2)碱溶液(或反应物)的浓度不同,反应温度不同(1分) M(1分) 过滤(1分)
(3)Cl2 + 2OH-→ClO- + Cl一+H2O (2分)
(4)
| 红(1分) | |
| 氯气与水反应生成的HClO将石蕊氧化为无色物质(1分) | |
| 黄绿(1分) | 继续通入的氯气溶于水使溶液呈黄绿色(1分) |
四、(本题包括2小题,共31分)
24. (11分)(1)NaC1+H2O+NH3+CO2→NaHCO3↓+NH4C1(1分)(2)NH3(1分),B,C(1分),先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出。(2分)
(3) (1分)(4)过滤(1分),漏斗(1分),坩埚(1分)(5)A、D(2分)
(1分)(4)过滤(1分),漏斗(1分),坩埚(1分)(5)A、D(2分)
25. (10分)
(1)①800 L·mol-1(3分,未带单位扣1分)。② =(1分)。
(2)1.60NA(或1.6NA) (2分);173.4(2分)。
(3)MFe2Ox+SO2![]() MFe2O4+S。(2分)
MFe2O4+S。(2分)
26、(10分)
(1)c(总)== c(H3PO4)+ c(H2PO4—)+ c(HPO42—)+ c(PO43—)(2分)
(2)HPO42—+H+== H2PO4—(1分) H2PO4—(1分)、HPO42—(1分)
(3)酸(1分)H2PO4—在溶液中的电离程度大于水解程度。(2分)
(4)>(1分),KOH抑制了PO43—的水解(1分)
27. (1)
羧基(1分)、羟基(1分) (2)①②③④(1分)
|
(3) (1分) (4)448(2分)
(5)
|
28.答案:(1)![]() -CH=CHCHO 羟基、醛基
-CH=CHCHO 羟基、醛基
(2)① ⑤
(3)2C2H5OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
![]() -CH2Cl+H2O
-CH2Cl+H2O![]()
![]() -CH2OH+HCl 氧化反应,消去反应
-CH2OH+HCl 氧化反应,消去反应
(4)3
29.答案:(1)![]() 离子键、非极性键 离子
离子键、非极性键 离子
(2)碳酸钠 O=C=O 直线型
(3)金刚石 NaCl为离子晶体而CCl4为分子晶体(4)4.0×10-8 cm