08届高三化学12月月考试题
可能用到的相对原子质量:H-1,C-12,N-14,O-16,F-19,Na-23,S-32,Cl-35.5,Cu—64,Ag—108
一、选择题(本题包括15小题,每小题2分,共30分,每小题只有一个选项符合题意)
1、下列有关环境问题的说法正确的是
A、燃煤时加入适量石灰石.可减少废气中SO2 的量
B、臭氧在空气中的体积分数只要不超过0.001%,就对人体有益无害
C、氟氯代烷会破坏臭氧层,但不会产生温室效应,加剧全球变暖问题
D、二氧化硫对人体有害,不可用作食物和干果的防腐剂
2、下列说法正确的是
A、电解稀盐酸和氯化钠饱和溶液,都会引起溶液中c(OH-)的增大(设电解前后温度不变)
B、向盛有氟化钠固体的烧瓶中加入浓H2SO4并加热,可制备HF
C、空气中的飘尘与酸雨的形成完全没有关系
D、在饱和FeCl3溶液中加入足量NaOH溶液,让一束光通过,可见丁达尔现象
3、已知:C60分子在一定条件下可与F2反应生成C60F60,则在C60晶体存在的化学键有
(1)离子键;(2)非极性键;(3)极性键;(4)范德瓦耳斯力;(5)不饱和键
A、(1)(2)(5) B、(2)(4)(5) C、(2)(3)(4) D、(2)(5)
4、已知某主族元素的离子A-,中子数为n,核外电子数为m,则下列说法正确的是
A、该元素的近似相对原子质量为(m+n+1)
B、该元素的近似相对原子质量为(m+n-1)
C、设一个碳原子质量为wg,则该原子的相对原子质量为12(m+n-1)/w
D、该离子的摩尔质量为(m+n-1)g·mol-1
5、现有一澄清透明溶液含有4种离子(不考虑水的电离),若适量铝能溶解在其中,以下各组离子中,不可能大量共存构成该溶液的是
A、Ba2+、Na+、OH-、Cl- B、K+、H+、NO3-、SO42- C、Na+、Cu2+、SO42-、Cl- D、Mg2+、Na+、NO3-、SO42-
6、已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是
A、A.B.E一定在不同周期 B、D为第二周期
C、A.D可能在同一主族 D、C.D的单质可能化合为离子化合物
7、氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟 B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应 D、生成1molN2有6mol电子转移
8、设NA代表阿伏加德罗常数,下列说法正确的是
A、将标准状况下4.48 L NO与2.24 L O2混合在一密闭容器中,容器内分子总数为0.2 NA
B、7.8 g Na2O2与足量CO2充分反应,转移电子数为0.2 NA
C、常温常压下,8.4 g NaF 晶体中,F-数目为0.2 NA
D、一定量的NaOH溶液与足量Al反应,每产生2.24 L H2,Al便失去电子0.2 NA
9、关于某无色溶液中所含离子的鉴别,下列判断正确的是
A、加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C、通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D、加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
10、氯酸钾和二氧化锰混合加热充分反应后冷却,在残留物中加入浓H2SO4并加热,产生的气体是( )
A、只有O2 B、只有SO2 C、Cl2和HCl D、只有HCl
11、下列各物质的熔点按由低到高的顺序排列是
A、石墨、金刚石、晶体硅 B、钾、钠、镁 C、冰、干冰、冰晶石 D、晶体硅、硅铝合金、铝
12、0.1mol/L的NaOH溶液0.2L,通入44.8mL(S.T.P.)H2S,所得溶液离子浓度大小关系正确的是
A、c(Na+)>c(OH-)>c(S2-) >c(HS-) B、c(Na+)=c(H2S)+c(HS-)+c(S2-)
C、c(Na+)+ c(H+)= c(HS-)+c(S2-)+c(OH-) D、c(S2-)+c(OH-)=c(H+)+c(H2S)
13、下列热化学方程式中△H的数值能表示可燃物燃烧热的是
A、CO(g)+![]() O2(g)=CO2(g);△H=-283kJ/mol
O2(g)=CO2(g);△H=-283kJ/mol
B、CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C、2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D、H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol
14、下列除去杂质的实验方法正确的是
A、除去CO中少量O2:通过灼热的Cu网后收集气体
B、除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C、除去NO2中的少量NO:再通入适量O2
D、除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
15、下列离子方程式书写不正确的是
A、将NaHSO4溶液滴加到Ba(OH)2溶液中至沉淀完全:Ba2++OH-+H++SO42-==== BaSO4↓+H2O
B、常温下向碳酸氢钙溶液中加入少量NaOH溶液:HCO3-+OH-==== CO32-+H2O
C、过量铁与稀HNO3反应:3Fe+8H++2NO3-==== 3Fe2++2NO↑+4H2O
D、在亚硫酸钠溶液中加入过量双氧水:2SO32-+H2O2 ==== 2SO42-+ 2H+
二、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意)
![]() 16、对可逆反应:N2+
3H2
2NH3(正反应放热)达平衡时,若分别增大压强和升高温度,两种情况下,对平衡体系正逆反应速率影响较大的依次是
16、对可逆反应:N2+
3H2
2NH3(正反应放热)达平衡时,若分别增大压强和升高温度,两种情况下,对平衡体系正逆反应速率影响较大的依次是
A、正反应速率,正反应速率 B、逆反应速率,逆反应速率
C、正反应速率,逆反应速率 D、逆反应速率,正反应速率
17、Na2CO3和NaHCO3组成的混合物与一定量的盐酸恰好完全反应,由下列数据不能求出混合物中Na2CO3质量分数的是
A、消耗HCl物质的量和生成水的质量 B、混合物的质量和生成CO2的物质的量
C、混合物的物质的量和生成NaCl物质的量 D、混合物的物质的量和生成CO2的质量
18、室温下,pH=a的醋酸溶液与pH=b的氨水等体积混合,恰好完全反应,设醋酸溶液与氨水中分别有m%的分子和n%的分子电离,则m与n的关系正确的是
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
![]() 19、反应:xA(气)+yB(气) zC(气),达到平衡时测得A气体的浓度为0.5mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol/L,则下列叙述正确的是
19、反应:xA(气)+yB(气) zC(气),达到平衡时测得A气体的浓度为0.5mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol/L,则下列叙述正确的是
A、x+y<z B、平衡向右移动 C、B的转化率升高 D、C的体积分数降低
20、下列有关化学实验的操作或说法中,正确的是
A、滴定管在清洗后,必须用待装液润洗一次方可用于滴定
B、电解饱和食盐水实验中,需要两根碳棒或两根铁钉作电极
C、少量金属钠可以保存在盛有煤油的细口瓶中
D、中和热的测定实验中,每一次反应,需要测量记录三个温度数据
![]()
![]() 21、在一容积可变的密闭隔热容器(如图)中发生反应:2SO2(g)+ O2(g) 2SO3(g)(正反应为放热反应),达到平衡时,体系温度为T,向容器中充入一定量相同温度的氦气后,下列说法正确的是
21、在一容积可变的密闭隔热容器(如图)中发生反应:2SO2(g)+ O2(g) 2SO3(g)(正反应为放热反应),达到平衡时,体系温度为T,向容器中充入一定量相同温度的氦气后,下列说法正确的是
A、体系压强增大 B、体系温度升高 C、SO2浓度增大 D、逆反应速率减小
22、用惰性电极和串联电路电解下列物质的水溶液:(1)NaCl;(2)NaNO3;(3)CuCl2;(4)AgNO3,在相同时间内生成气体的总体积(同温同压下测定),理论上由多到少的顺序是
A、(1)(2)(3)(4) B、(4)(1)(2)(3) C、(2)(1)(3)(4) D、(1)(2)(4)(3)
23、镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是:
Cd+2OH--2e-===Cd(OH)2;2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-。下列说法不正确的是
![]() A、电池总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2 B、电池充电时,镉元素被还原
A、电池总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2 B、电池充电时,镉元素被还原
C、电池放电时,电池负极周围溶液的pH不断增大 D、电池充电时,电池负极和电源负极连接
24、14gCu、Ag合金与足量某浓度的硝酸反应,将放出的气体与1.12L O2(标况)混合,恰好能被水全部吸收生成硝酸,则合金中Cu的质量为
A、1.6g B、3.2g C、6.4g D、9.6g
25、用密度为D g/cm3,质量分数为n%的浓HCl,配制成体积比为1:4稀HCl(稀HCl的密度为d g/cm3),则所配溶液的物质的量浓度为
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
三、非选择题(50分)
 26、(8分)已知X是一种常见的白色固体,
26、(8分)已知X是一种常见的白色固体,
D、E是两种常见固体单质,B是常见气体,
现有如图转化关系:回答下列问题:
(1)写出X、Y的化学式:
X________________Y________________;
(2)B与D点燃时发生反应的反应式为_____________________________________;
(3)过量B与溶液C发生反应的离子方程式为______________________________________。
27、(8分)长期以来一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,对次氟酸的研究引起充分重视。
(1)制备次氟酸的反应式______________________________; 次氟酸的电子式为_______________。
(2)次氟酸能与水反应得溶液A,A中含B、C两种溶质,B是一种极难被氧化的物质,C既有氧化性又有还原性,写出次氟酸与水反应的化学方程式____________________________________________。
(3)将溶液A滴入紫红色酸性高锰酸钾溶液中,紫红色褪去,有Mn2+生成,写出这一反应的离子方程式______________________________________________
28、(10分)有一包固体粉末,可能含有的离子有K+、NH4+、Fe3+、Na+、Cl-、NO3-、I-、SO42-。取试样加蒸馏水全部溶解,溶液呈无色透明。在此溶液中,先加入Ba(NO3)2溶液,无明显现象;再加入AgNO3溶液,有白色沉淀产生;然后过滤,浓缩,加入铜片、浓硫酸,共热,有红棕色气体产生;最后,对试样进行焰色反应,透过蓝色钴玻璃观察火焰呈浅紫色。试回答下列问题:
(1)这包粉末中,肯定存在的离子是________________;肯定不存在的离子是__________________;可能存在的离子是__________________。
(2)写出实验过程中有关反应的离子反应方程式
__________________________________________________________________________________。
29、(10分)A—E是中学化学实验中几种常见的气体发生装置示意图,请为以下气体制备实验选择合适的装置,将编号①—⑧填入对应装置图下方的空格中。若有多个适合的装置,则都选上;若没有适合的装置,则不必选;若多选要倒扣分。
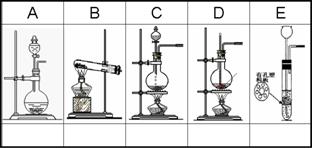 ①浓H2SO4(70%)与Na2SO3微热制SO2;
①浓H2SO4(70%)与Na2SO3微热制SO2;
②电石与水反应制乙炔;
③Zn与稀H2SO4反应制氢气;
④实验室用NH4Cl和Ca(OH)2制NH3;
⑤苯与浓H2SO4 .浓HNO3混合酸反应制硝基苯
⑥实验室制氯气;
⑦实验室制乙烯;
⑧赤热焦炭与高温水蒸气反应制水煤气。
30、(14分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2.5 g CuSO4·5H2O,研细后倒入50mL烧杯,加20 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀;
③过滤,洗涤沉淀;
④将沉淀转移到蒸发皿中,加热至沉淀全部变为黑色,研细备用。
回答下列问题:
(1)上述各实验步骤中都要用到玻璃棒,请分别写出其作用:
①_________________、②_________________、③_________________、④_________________;
(2)步骤①、④中研磨固体所用仪器的名称是___________________;
(3)步骤③中洗涤沉淀的操作是_________________________________________________________。
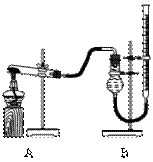 (二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。用下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。用下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ① | 1.2 g | 无其他物质 | ? |
| ② | 1.2 g | CuO 0.5 g | ? |
| ③ | 1.2 g | MnO2 0.5 g | ? |
回答下列问题:
(1)上述实验中的“待测数据”指_____________;
(2)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
(3)若要证明实验②中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,_____________________________________________________________;
(4)为探究CuO在实验②中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,b.CuO的化学性质有没有改变。
![]()
 08届高三月考-12月 化学答卷
08届高三月考-12月 化学答卷
选择题(50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 |
| ||||
| 答案 |
| |||||||||
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 答案 | ||||||||||
非选择题(50分)
26、(1)X________________ Y________________;
(2) __________________________________________________________________________;
(3) __________________________________________________________________________。
27、(1) ____________________________________________; ______________________。
(2) __________________________________________________________________________;
(3) __________________________________________________________________________。
28、(1)肯定存在的离子是____________________;肯定不存在的离子是____________________;可能存在的离子是____________________。
(2)______________________________________________________________________________。
29、
30、(一)
(1) ①_________________________________、②_________________________________、
③_________________________________、④_________________________________;
(2)___________________;
(3) ______________________________________________________________________________。
(二)
(1) ____________________________________;(2) ____________________________________。
(3) ______________________________________________________________________________;
(4)a.________________________________________________。
08届高三月考-12月 化学答卷
选择题(50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | A | D | D | D | B | C | C | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 |
| ||||
| 答案 | B | A | A | D | D |
| ||||
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 答案 | C | D | A | D | D | D | A | C | B | C |
非选择题(50分)
![]() 26、(1)X:CaCO3 、Y:Ca(OH)2 ;
26、(1)X:CaCO3 、Y:Ca(OH)2 ;
(2) CO2 + 2Mg 2MgO + C;
(3) CO2 + OH- ==== HCO3-。
![]() 27、(1) F2+H2O====HF+HFO;
。
27、(1) F2+H2O====HF+HFO;
。
(2) HFO + H2O ==== HF+ H2O2 ;
(3) 2MnO4- + 5H2O2 + 6H+ ==== 2Mn2+ + 5O2↑ + 8H2O。
28、(1) K+、Cl-; Fe3+、、I-、SO42-; NH4+、Na+、、NO3-。
(2) Ag+ + Cl- ==== AgCl↓ ; Cu + 4H+ + 2NO3- ==== Cu2+ + 2H2O+ 2NO2↑ 。
29、
| 2、3 | 4 | 1、6 | 7 | 3 |
30、(一)
(1) ①搅拌,促进溶解、 ②搅拌,使混合均匀(或充分反应)、
③引流,防止液体溢出(或溅出)、 ④转移固体; 搅拌,使受热均匀;
(2)研钵;
(3)沿玻璃棒向过滤器(或漏斗)中加水,至浸没沉淀,待水滤出,重复操作2~3次。
(二)
(1) 收集25mL气体所需时间;(2) 碱式。
(3) 将带火星木条伸入干燥管中,看木条是否复燃,若复燃,则说明收集的气体是氧气;
(4)a.CuO的质量有没有改变。