08届高三化学1月月考试题
注意:1、本试卷分选择题和非选择题两部分,满分150分,考试时间120分钟。
2、请将试卷答案用黑色笔填入答卷对应地方,超出无效。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Ca 40 Cu 64 Fe 56 I 127 K 39 Cl 35.5
第一部分 选择题 (共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)

1.2007 年 10 月 24 日 18 时 05 分,就在这天与山、山与水的环拥之中,
“嫦娥奔月”, 一个流传了千年的神话,中国首颗探月卫星发射,在有着“月
亮城”之称的高原航天城梦想成真。发射嫦娥一号卫星的长征三号甲运载火
箭的第三级发动机使用的低温燃料为液氧和液氢。下列有关说法不正确的是
A.液氧和液氢最好在临发射前的一段时间加注。
B.氧气比氢气较易液化
C.燃烧产物对发射环境没有污染。
D.用液氧和液氢做火箭燃料,主要是因为氢气燃烧能放出大量的热量。
2.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将:FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5~36 nm的磁流体。下列说法中,正确的是
A.所得的分散系属于溶液
B.所得的分散系中分散质为Fe2O3
C.当一束强可见光通过该分散系会出现光亮的通路
D.该分散系不属于介稳体系
3.目前人类已发现的非金属元素除稀有气体外共有16种,下列对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸。2.43
A.只有①②正确 B.只有①③正确
C.只有④正确 D.①②③④均不正确
4. 据诺贝尔奖官方网站报道,瑞典皇家科学院诺贝尔奖委员会将2007年度诺贝尔化学奖授予德国科学家格哈德•埃特尔(Gerhard Ertl),以表彰他在“固体表面化学过程”研究中作出的贡献。下列为该研究所涉及的项目中说法正确的是
据诺贝尔奖官方网站报道,瑞典皇家科学院诺贝尔奖委员会将2007年度诺贝尔化学奖授予德国科学家格哈德•埃特尔(Gerhard Ertl),以表彰他在“固体表面化学过程”研究中作出的贡献。下列为该研究所涉及的项目中说法正确的是
A.汽车尾气中CO可在铂表面转为CO2
B.合成氨工业中N2和H2在氧化铁表面进行
C.氢氧燃料电池的电极均作为反应物参加电极反应
D.臭氧层的破坏主要与氟氯烃的氟原子有关
5.英国研究人员 2007 年 8 月 30 日发表报告认为,全球将有 1.4 亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡 24 小时后,其含砷量才能达到食用安全标准。下列对砷 ( As )的有关判断正确的是
A.砷原子序数为 33 ,它与铝为同主族
B.砷的原子半径小于磷的原子半径
C.砷化氢的稳定性比溴化氢的强
D.砷酸的酸性比硫酸的弱
6.下列操作中,完全正确的一组是
① 用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
② 给盛有液体的体积超过1/3容积的试管加热 ③ 把鼻孔靠近容器口去闻气体的气味
④ 将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤ 取用放在细口瓶的液体时,取下瓶塞倒立放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥ 将烧瓶放在桌上,用力塞紧塞子 ⑦ 用坩埚钳夹取加热后的蒸发皿
⑧ 将滴管垂直伸进试管内滴加液体 ⑨ 稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩ 检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热。
A.①④⑦⑩ B.①④⑤⑦⑩ C.①④⑤⑦⑧⑩ D.④⑤⑦⑧⑩
7.下列叙述中正确的是
① 金属钠不能与NaOH溶液反应;
②液溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯;
③溴化银具有感光性,碘化银不具感光性;
④某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水;
⑤氟气能与氯化钠水溶液反应生成HF和O2;
⑥过氧化钠跟水反应时,水既不是氧化剂也不是还原剂。
A.只有①③⑤ B.只有②④⑥ C.只有②⑤⑥ D.只有①③④
8.等物质的量的下列物质:①NaHSO4 ②Ca(H2PO4)2 ③Si ④Al2(SO4)3
|
⑤ 分别与足量的NaOH溶液反应,耗碱最由多到少的顺序正确的是
A.②⑤④③① B.④②③⑤① C.④②⑤③① D.④⑤②③①
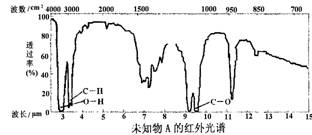 9.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中不正确的是
9.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中不正确的是
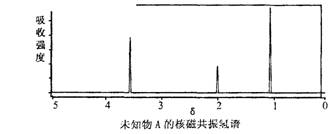
A.由红光外谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
10.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是
A.Na+、Mg2+、S2—、ClO— B.H+、Na+、SO42-、NO3—
C.K+、Ca2+、OH—、SO32— D.Na+、K+、Cl-、OH-
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
11.2008年北京奥运会“祥云”火炬用的是环保型燃料——丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5kJ/mol,下列有关说法正确的是
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=2221.5kJ/mol
12.下列离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O
B.向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:
Ca2++HCO3-+OH-===CaCO3↓+ H2O
C.将铝片投入到冷的浓硝酸中:
Al+NO3-+4H+=====Al3++NO↑+ 2H2O;
D.二氧化硅和氢氧化钠溶液反应:
SiO2+2OH-+H2O ===SiO32- + 2H2↑
13.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.用MnO2催化H2O2分解时,每生成11.2L的O2转移NA个电子
B.标准状况下,22.4L SO3中含有的硫原子数目为NA
C.标准状况下,2.24L氧元素的单质所含原子数一定为0.2NA
D.6.4g S6与S8的混合物中所含硫原子数一定为0.2NA
14.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH明显升高
C.阳极反应方程式为:2Cl--2e-=Cl2↑
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
15.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
![]() 2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a
kJ·mol-1
2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a
kJ·mol-1
在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是
A.4molSO2和2molO2 B.5molSO2和3molO2
C.4molSO2和4molO2 D.2molSO2、1molO2和2molSO3
16.NaHCO3和Na2CO3·10H2O晶体的混合物10g,溶于水制成200mL溶液,其中c(Na+)=0.50mol/L。若将10g的这种混合物,加热到质量不变为止,减少的质量为
A.5.3g B.4.7g C.5.0g D.4.0g
17.茉莉醛具有浓郁的茉莉花香,其结构简式如下所示: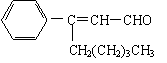
关于茉莉醛的下列叙述不正确的是
A.茉莉醛与苯甲醛互为同系物
B.在加热和催化剂作用下,能被氢气还原生成一种芳香醇
C.一定条件下,能被银氨溶液、新制氢氧化铜等多种氧化剂氧化
D.不能与氢溴酸发生加成反应
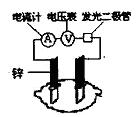
18.有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
| 实验次数 | 电极材料 | 水果品种 | 电极间 距/cm |
/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
| 甲同学 | 乙同学 | |
| A | 实验6中的负极电极反应如何写? | 铝为负极:Al-3e-=Al3+ |
| B | 实验1,5电流方向为什么相反? | 1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不太亮,如何使它更明亮起来? | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
![]()
C.pH=1的醋酸与盐酸分别加水稀释 D.氨气通入醋酸溶液中
19.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象;①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是( )
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
20.已知酸式盐NaHB在水溶液中存在下列反应:
①NaHB == Na+
+ HB-,②HB-![]() H++B2-,③HB-+H2O
H++B2-,③HB-+H2O ![]() H2B+OH-
H2B+OH-
且溶液中c(H+)>c(OH-),则下列说法一定正确的是
A.NaHB为强电解质 B.H2B为强酸
C.H2B为弱电解质 D.HB-的电离程度小于HB-的水解程度
第二部分 (非选择题共80分)
三、(本题包括3小题,共32分)
21.(8分)硝酸钾是一种用途广泛的化工原料,工业中利用温度对溶解度的影响,常用硝酸钠与氯化钾按一定比例混合结晶得到。
请填写下表中的空格,并回答相关问题。
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 称量、溶解 | 称取20 g硝酸钠和 17 g氯化钾,溶解在 35 Ml 蒸馏水 |
| ② | 蒸发 | 加热蒸发,当 停止加热 |
| ③ | 过滤 | 在承接滤液的烧杯应预先加2mL的蒸馏水,趁热过滤, |
| ④ | ||
| ⑤ | 减压过滤得到粗产品 | |
| ⑥ | 重结晶 得到产品 |
(1)在步骤③中趁热过滤的目的是: ,在热过滤中,承接滤液的烧
杯应预先加2mL的蒸馏水,其作用是: 。
(2) 步骤③、④两次过滤后都应该用少量蒸馏水洗涤晶体,步骤③应用 水、步骤④ 水(填“冷、热”)
(3)实验中得到的粗产品和产品在成分上有明显的区别,请用实验加以区分(简述实验过程)
22、(10分)化学研究小组,通过网上查找资料发现,Cl2的制取有下列不同方案:
![]() 方案:加热条件下二氧化锰与浓盐酸反应制得Cl2
方案:加热条件下二氧化锰与浓盐酸反应制得Cl2
![]() 方案:浓盐酸与氯酸钾固体反应制得Cl2
方案:浓盐酸与氯酸钾固体反应制得Cl2
![]() 方案:电解饱和食盐水法制得Cl2
方案:电解饱和食盐水法制得Cl2
现实验室有供选择的如下几种仪器来制取Cl2
 | |||||||
 | |||||||
 | |||||||
 | |||||||

A B C D E
(1)用上述仪器不能实现的方案为 。不考虑固定装置的仪器,可行但缺仪器的方案是 ,所缺的仪器是 。
(2)若按b方案制Cl2时发生化学方程为_______________________,要制取并收集纯净的Cl2(允许含有少量水蒸气或空气),须使用到的上述仪器中的(按气流从左到右的流向顺序列出)___ (填A、B、C……)。
(3)若要设计联合实验探究氯气的漂白原理,从制备装置中产生氯气后应连接的装置是(画出装置图并注明所使用的试剂或用品)
23.(12分)铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点。某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg· L-1、体积 100 L的水溶液。通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg,。
(1) 阳极电极反应方程式 .
(2)理论上阴极生成的气体在标准状况下的体积为 L。
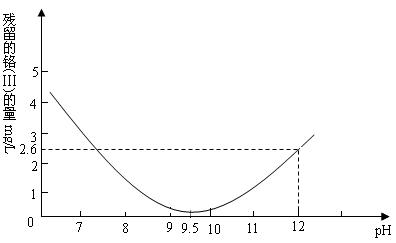
(3) 已知:酸性条件下Cr3+ 不与S2-反应。某研究小组设计实验回收含该电镀废液(主要含Cu2+,Cr3+,Cr2O72-)中的铬,所用到的试剂有Na2SO3,Na2S,NaOH[铬以Cr(OH)3形式回收],写出该小组的实验方案所涉及到的离子方程式: 、 、 。
(4) 上述实验铬的回收效率与NaOH的用量有关,如下图所示,则反应Cr(OH)3+OH-![]() Cr(OH)4-的平衡常数K=
。为获取铬的最佳回收效果该小组的实验过程中,应采取的措施是
。
Cr(OH)4-的平衡常数K=
。为获取铬的最佳回收效果该小组的实验过程中,应采取的措施是
。
![]()
24、利用天然气合成氨的工艺流程示意如下:
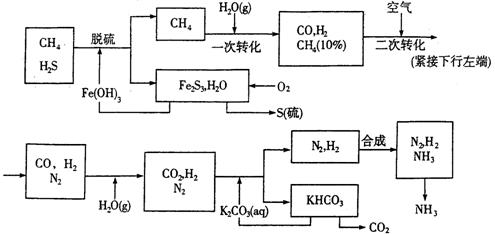
依据上述流程,完成下列填空:
(1)n mol CH4经一次转化后产生CO 0.9n mol,产生H2 mol(用含n的代数式表示)
(2)K2CO3(aq)和CO2反应在加压进行,加压的理论依据是 (多选扣分)
a.相似相溶原理 b.平衡移动原理 c.酸碱中和原理
(3)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途。)
(4)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,三是 循环。
25、(1)以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表 (g/100g水)
| 温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | — | — | — | — |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为_________________ ;
②加料完毕,保温30分钟,目的_____________________________ ;
③静置后只析出NaHCO3晶体的原因_______________________________ ;
④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
(2)我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
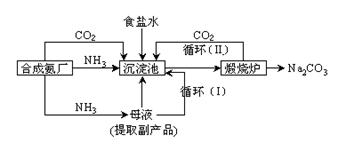
⑤沉淀池中反应的化学方程式: _______-_______ __ ;
⑥检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
⑦循环(I)中应该加入或通入物质的化学式为 。
26、.(12分)氨是一种重要的化工原料,氨的的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中,N2+3H2![]() 2NH3 △H<0
2NH3 △H<0
①该反应的平衡常数K的表达式为:K=_______。升高温度,K值 (填“增大”、“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3 )
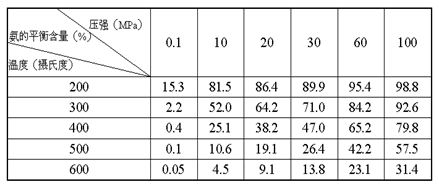
表中数据, ℃ MPa时H2的转化率最高,实际工业生产不选用该条件的主要原因是 。
③下列关于合成氨说法正确是
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2==2N2+6H2O。写出负极电极反应式 ,你认为电解质溶液应显 性(填“酸性”、“中性”、“碱性”),其原因是 。
五、(本题包括1小题,共10分)
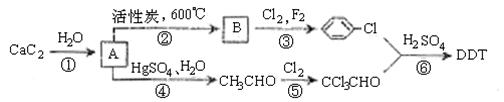
27.瑞士昆虫学家保罗·米勒因合成DDT于1948年获得诺贝尔生理医学奖。联合国世界卫生组织曾评价说:“单独从疟疾看,DDT可能拯救了5000万生命”。但进一步的观察与研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒,我国于1983年停止生产和使用DDT。DDT可以用电石为原料经以下途径制得。
|
(1)写出A、B的结构简式:A ,
B 。
(2)写出第⑤步反应的化学方程式: 。
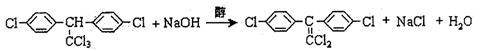
|
实现这种转化。表示这种转化的化学方程式为 。
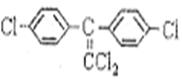
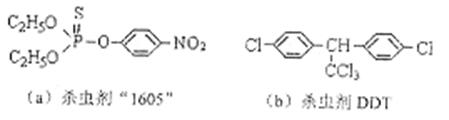
(4)杀虫剂“1605”属于硫代磷酸脂(性质类似于酯),本身对人畜毒性远强于DDT,
|
六、选做题(本题包括2小题,每小题10分,考生只能选做一题。28小题为“有机化学基础”内容的试题,29题为“物质结构与性质”内容的试题)
考生注意:
28、29题为选做题,考生可任选一题。先在答题卡指定位置填写你所选择的试题号,再按要求答题,如果不填试题号,一律按0分计。28题适合选修《有机化学基础》模块的考生解答,29题适合选修《物质结构与性质》模块的考生解答。
28.仔细体会下列有机合成过程中碳骨架的构建及官能团的引入和转化,完成下题:
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
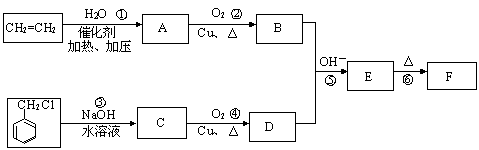
已知:反应⑤为羟醛缩合反应。请回答:
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)反应①~⑥中符合原子经济性的是 。
(3)写出下列转化的化学方程式:② ,③ 。
写出有关反应的类型:② ⑥ 。
(4)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
29.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子空间构型为 。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填“名称”);晶体ZW的熔点比晶体XW4明显高的原因是 。
(4)ZW晶体的结构示意图如下。已知:ρ(ZW)=2.2
g·cm-3,NA=6.02×1023 mol-1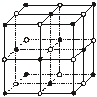 ,则ZW晶体中两个最近的Z离子中心间的距离为
,则ZW晶体中两个最近的Z离子中心间的距离为
第一、二选择题答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | D | A | D | A | C | C | D | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | AB | D | CD | B | B | AD | C | A | AC |
第二部分 (非选择题共80分)
三、(本题包括3小题,共32分)
21.(8分)
(1)(2分)避免溶液冷却时硝酸钾晶体析出。防止降温时氯化钠溶液达饱和而析出。
(2)热、冷(每空1分)
(3)(4分) 取少量样品置于干净的试管中,加入少量蒸馏水溶解,加硝酸酸化后加入硝酸银溶液观察是否有白色沉淀生成。有则样品是粗产品,无则产品及格。
22、(12分)
(1)c(1分), a(1分), 酒精灯(1分) (2)方程式略(2分)。EBC(或ED:排饱和食盐水法)(2分)
(3)图略(流程:干燥---通入干的红布条-----通入显的红布条-----通氢氧化钠溶液)(4分,装置2分,试剂2分)
23(12分)(1) 4OH--4e-= O2↑+2H2O (2) 1606 L。
(3) Cr2O72-+3SO32-+8H+= 2Cr3++3SO42-+4H2O;Cu2++S2-== CuS↓;Cr3++3OH-== Cr(OH)3↓
(4) K=5;调节溶液的pH值为9.5。
24、
(1)2.7n(2)b(3)生产纯碱(或制作冷剂等,其它合理答案也给分)(4)N2、H2
25、
.①:水浴加热、②:使反应充分进行 (或使NaHCO3晶体充分析出)③:NaHCO3的溶解度最小④:NaCl⑤: NH3+CO2+H2O + NaCl=NH4Cl+NaHCO3↓或 NH3+CO2+H2O=NH4HCO3 ;NH4HCO3+NaCl=NaHCO3↓+NH4Cl⑥可取少量试样溶于水,滴加过量稀硝酸,再滴加过量硝酸银,观察最终是否有沉淀 ⑦NH3
26、
(12分)(1)①![]() 增大
增大
② 200℃ 100MPa 200℃时反应速率过低。③B
(2)2NH3+60H--6e-=N2+6H2O,碱性,NH3在碱性介质中易转化为NH4+离子。
|
(1)CH≡CH,
|
(3)
(4)“1605”属于酯类可以水解成小分了,杀虫剂DDT不能水解成小分子
28.答案:(1)![]() -CH=CHCHO 羟基、醛基
-CH=CHCHO 羟基、醛基
(2)① ⑤
(3)2C2H5OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
![]() -CH2Cl+H2O
-CH2Cl+H2O![]()
![]() -CH2OH+HCl 氧化反应,消去反应
-CH2OH+HCl 氧化反应,消去反应
(4)3
29.答案:(1)![]() 离子键、非极性键 离子
离子键、非极性键 离子
(2)碳酸钠 O=C=O 直线型
(3)金刚石 NaCl为离子晶体而CCl4为分子晶体(4)4.0×10-8 cm
 电压
电压