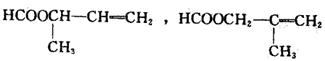08届高三化学2月统一考试试题
化 学 试 题
注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,第I卷41分,第II卷59分,全卷满分100分,考试时间90分钟。
2.答第I卷前,务必将自己的姓名、考号、考试科目涂写在答题卡上。每题选出答案后,都必须用2B铅笔把答题卡上对应题目的答案标号(A、B、C、D)涂黑,如需改动,必须用橡皮擦干净,再改涂其它答案。
3.答第II卷前,务必将密封线内的项目填写清楚。必须用钢笔或圆珠笔直接答在试卷上,密封线内一律不准答题。
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5
K 39 Ca 40 Mn 55 Fe 56 Cu 64 Br 80 Ag 108 I 127
第Ⅰ卷(必做 共41分)
一、选择题(本题包括20小题,每题2分,共40分。每小题只有一个选项符合题意)
1.2008年将在我国北京举行夏季奥运会,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指 ( )
A.把环境保护作为奥运设施规划和建设的首要条件
B.运动员的食品全部是未加任何添加剂的食品
C.奥运场馆建设均使用天然材料建造,不使用人工合成材料
D.所有奥运用品全都是绿色的
2.“嫦娥奔月”是一个充满浪漫主义的中国神话故事。2007年10月24日我国“嫦娥一号”探月卫星由长三甲火箭送入预定的轨道。长三甲火箭第三级推进剂采用低温液氧/液氢。已知在298K时,2g氢气与氧气完全反应生成液态水放热285.8kJ,则此反应的热化学方程式为下列的 ( )
A.2H2(g)+O2(g) === 2H2O(l) △H=-285.8KJ·mol-1
B.2H2(g)+O2(g) === 2H2O(l) △H=+285.8KJ·mol-1
C.H2(g)+![]() O2(g) === H2O(l) △H=-285.8KJ·mol-1
O2(g) === H2O(l) △H=-285.8KJ·mol-1
D.H2(g)+ ![]() O2(g) === H2O(g) △H=-285.8KJ·mol-1
O2(g) === H2O(g) △H=-285.8KJ·mol-1
3.已知“凡气体分子总数增多的反应一定是熵增大的反应”。根据所学知识判断,下列反应中,在所有温度下都不自发进行的 ( )
A.2O3(g) === 3O2(g) △H<0
B.2CO(g) === 2C(s)+O2(g) △H>0
C.N2(g) + 3H2(g) === 2NH3(g) △H<0
D.CaCO3(s) === CaO(s) + CO2(g) △H>0
4.下列对物质用途的描述中,错误的是 ( )
A.镁铝合金密度较小、强度高,常用作制造航天器的材料
B.Cl2、SO2、NaClO均可用于漂白
C.浓硫酸具有吸水性,可用于干燥HCl、H2S、O2
D.可通过铝热反应冶炼某些熔点较高的金属
5.下列现象中,不能用胶体知识解释的是 ( )
A.向豆浆中加入盐卤可制作豆腐
B.清晨在密林中看到一缕缕光束
C.向FeCl3溶液中加入Na2CO3溶液,会出现红褐色沉淀
D.在河水与海水的交汇处,有沙洲形成
6.下列反应的离子方程式中,书写正确的是 ( )
A.向氢氧化钠溶液中通入少量二氧化硫:SO2+OH—=== HSO—3
B.碳酸氢钠溶液与过量氢氧化钡溶液混合:HCO—3+Ba2++OH—===BaCO3↓+H2O
C.将盐酸滴入氨水中:H++OH—=== H2O
D.碳酸钙溶液解于稀硝酸:CO2—3+2H+===CO2↑+H2O
7.若NA为阿伏加德罗常数的值,下列说法中,正确的是 ( )
A.1mol Na2O2与CO2完全反应,转移的电子总数为2NA
B.34g氨中含有12NA个N—H键
C.8.4g NaHCO3晶体中所含阴阳离子的总数为0.2NA
D.25℃时,100mL 1 mol·L—1 Na2S溶液中S2—总数等于0.1NA
8.将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.3 mol·L—1 HCl溶液 B.4 mol·L—1 HNO3溶液
C.5 mol·L—1 NaOH溶液 D.18.4 mol·L—1 H2SO4溶液
9.若两物质恰好完全发生化学反应,下列各项中,反应前后肯定不发生变化的是 ( )
①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量
A.④⑤ B.②⑤ C.①②③⑤ D.①②⑤
|
能发生的化学反应是 ( )
①氧化反应 ②取代反应 ③加成反应 ④消去反应 ⑤还原反应
⑥酯化反应 ⑦水解反应 ⑧聚合反应
A.② B.④ C.⑥ D.⑧
11.下列叙述中,错误的是 ( )
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH—)增大
D.在纯水中加入少量硫酸铵,可抑制水的电离
12.下列说法中,正确的是 ( )
A.丙烯的结构简式可以表示为CH3CHCH2
B.用酒精可以将溴水中的溴萃取出来
C.乙烷、乙醇和乙酸都能发生取代反应
D.油脂都不能使酸性高锰酸钾溶液褪色
13.25℃时,下列各组离子在酸性环境中能大量共存的是 ( )
A.Ca2+、Al3+、Cl—、NO—3 B.Fe3+、Cu2+、Cl—、HCO—3
C.K+、Na+、SO2—3、S2— D.K+、Ba2+、I—、NO—3
14.根据相关化学原理分析,下列推断正确的是 ( )
A.若X的质子数为a,中子数为b,则X的质量数为:a—b
B.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性比较为:NaA的<NaB的
C.若R2—和M+的电子层结构相同,则原子序数的比较为:R的>M的
D.若有反应A2 + 2D—=== 2A—+D2,则氧化性的比较为:D2的>A2的
15.“神舟六号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2 === 2H2O,负极反应为H2+CO2—3→CO2↑+H2O+2e—,则下列推断中,正确的是 ( )
A.电池工作时,CO2—3向负极移动
B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极
C.正极的电极反应为:4OH—→O2↑+2H2O+2e—
D.通氧气的电极为阳极,发生氧化反应
16.有BaCl2和KCl的混合溶液VL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl—离子完全沉淀。反应中消耗m mol H2SO4、n mol AgNO3。据此得知原混合溶液中的K+的物质的量浓度为 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
![]() 17.将1 mol SO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发
17.将1 mol SO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发
生反应:2SO2(g) + O2(g) 2SO3(g)。反应达到平衡时SO3为0.3mol。若此时移走0.5mol O2和0.5molSO2,则重新达到平衡后,SO3的物持的量为下列的 ( )
A.等于0.3mol B.等于0.15mol
C.小于0.15mol D.大于0.15mol,小于0.3mol
|
二、(本大题包括5小题,共51分)
18.(8分)(1)安全教育是化学教育的重要内容。根据你掌握的知识判断,下列各项中,符合安全操作要求的是 (填写序号)。
①在加油站内拨打手机
②在煤矿巷道内用明火照明
③闻氯气的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔
④为了节约药品,锌与稀硫酸一开始反应,就做氢气点燃实验
⑤稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌
(2)下图为常见仪器的部分结构(有的仪器被放大)
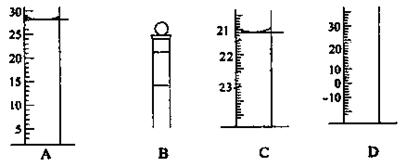
A图中液面所示溶液的体积为 mL,C图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时讯数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是 (填仪器序号字母)。
(3)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的瓷质仪器的名称为 。
②该同学将所得精盐配成溶液,用于另一实验。实验中需要用100ml 1mol·L—1的NaCl溶液,配制过程中需用托盘天平称取的精盐质量为 g,用于定容的玻璃仪器的规格和名称 。
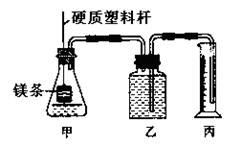
|
①配制浓度均为1 mol·L—1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL 1mol·L—1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁带(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁带浸入酸中至反应完全。
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法: 。
(2)量取10.00mL 1 mol·L—1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是
(填下列各项序号字母)
A.50mL量筒 B.10mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁带质量不能少于 g。
(4)步骤⑤中需记录的数据是 ;实验过程中观察到的主要现象是
。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为 (填“偏大”、“偏小”或“无法确定”)
(6)为保证实验顺利进行,仪器丙应选用的规格是 (填序号字母)。
A.100mL B.200mL C.500mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为 L·mol—1。
|
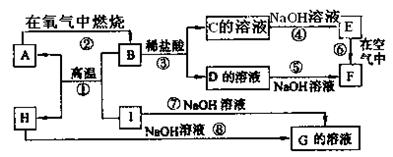
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在元素周期表中位置 。
(2)写出C、H物质的化学式:C ,H 。
(3)写出反应①、⑦的化学方程式:
反应①: 。
反应⑦: 。
(4)反应⑥过程中的现象是 。
|
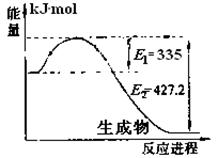
(1)右图是N2和H2反应生成2molNH3过程中能
量变化示意图,请计算每生成1molNH3放
出热量为 。
(2)在定体积的密闭容器中,进行如下化学反应:
![]() N2(g)+3H2(g) 2NH3(g),其化学平衡
N2(g)+3H2(g) 2NH3(g),其化学平衡
常数K与t的关系如下表:
| t/K | 298 | 398 | 498 | …… |
| K/(mol·L—1)—2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(N2)(正) = v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl—)>c(N2H2+6)>c(H+)>c(OH—)
B.c(Cl—)>c([N2H5·H2O]+)>c(OH—)>c(H+)
C.2 c(N2H2+6)+c([N2H5·H2O]+)+ c(H+) = c(Cl—)+c(OH—)
D.c(N2H2+6) > c(Cl—)> c(H+) >c(OH—)
22.(12分)汞单质及其化合物在工业生产和科学研究上有广泛的用途,汞唯一重要的矿源是朱砂(HgS)。朱砂炼汞的反应之一为:
HgS+O2 Hg+SO2
请回答下列问题:
(1)HgS与O2的反应中,氧化剂是 ,每生成1molHg转移电子的物质的是为 mol。
(2)电解某汞的硝酸盐溶液,当阴极消耗a mol金属阳离子时,可获得2a mol金属单质,同时阳极可得0.5a mol的气体产物。则该气体产物是 (填化学式),由此可推断断得知该盐的化学式是 。其阳极上的电极反应式是 。
(3)随着冶炼、电镀等工业生产的不断发展,所需汞及其化合物的用量也日趋增多,随之排放出来的含汞的废水也愈加严重,现已成为世界上危害较大的工业废水之一。以下处理含汞(Hg2+)废水的方法中最简单实用的是 (填序号)。
A.向含Hg2+的废水中加入Na2S等可溶性硫化物
B.加入金属还原剂
C.电解法
选做部分
三、(本题包括2小题,请从23、24两小题中任选一题作答,每小题8分。若两小题都做,只按23小题计分)
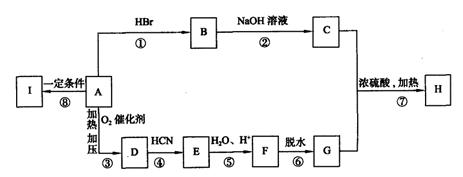
23.(8分)[化学—有机化学基础]
|
请回答下列问题:
(1)物质D和I的结构简式为:D 、I 。
(2)指出反应类型:反应④属 ;⑥属 。
(3)写出下列反应的化学方程式:
反应② 反应⑦
(4)写出与H具有相同官能团且只含有一个甲基的同分异构体的结构简式(除H外,请写出任意两种) , 。
24.(8分)[化学—物质结构与性质]
今有位于元素周期表短周期中X、Y、Z三种元素。已知:
①三者原子序数之和为25;
②元素Y的原子价电子排布为ns2npn+2
③X和Y在不同条件下可形成X2Y和X2Y2两种固态化合物,Y和Z在不同条件下可形成ZY和ZY2两种气态化合物;
④元素Z的硫化物与元素Z的氯化物,常温下均为液态,且二者的相对分子质量之比为38:77。
据此填写下列空白:
(1)写出元素符号:X ;Y ;Z 。
(2)X2Y2属于 晶体,构成晶体的微粒是 (填微粒符号)
(3)Z的硫化物的分子空间构型是 ,ZY2形成的晶体属于
晶体,根据原子轨道重叠方式的不同,Z的氯化物分子中含有的共价键种类及数目是 。
参考答案
一、选择题(本题包括17小题,1—10小题每小题2分,11—17小题每小题3分,共41分。每小题只有一个选项符合题意)
1.A 2.C 3.B 4.C 5.C 6.B 7.C 8.A 9.D
10.C 11.D 12.C 13.A 14.B 15.A 16.D 17.C
|
18.(8分)(1)③⑤(2分)
(2)28.0;21.10;C(各1分)
(3)①蒸发皿 ②5.9或5.8;100mL容量瓶(各1分)
19.(12分)(1)用两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气(2分,只要表述正确、合理均可)
(2)C(1分)
(3)0.12(2分)
(4)反应的起止时间(1分);盛盐酸的锥形瓶中反应较剧烈,生成氢气的速率较大,反应完全用时少。最后排出水的体积基本一致。(2分)
(5)偏大(1分)
(6)B(1分)
(7)0.2V L/mol(2分)
20.(9分)(1)第四周、第VIII族(1分)
(2)FeCl2;Al2O3(各1分)
(3)8Al+3Fe2O4 4Al2O3+9Fe(2分)
2Al+2NaOH+6H2O === 2Na[Al(OH)4]+3H2↑(2分)
(或2Al+2NaOH+2H2O === 2NaAlO2)+3H2↑)
(4)生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色(2分)
21.(每空2分,共10分)(1)46.1kJ
(2)①>② C
![]() (3)①N2H2+6+H2O [N2H5·H2O]++H+ ②AC
(3)①N2H2+6+H2O [N2H5·H2O]++H+ ②AC
22.(每空2分,共12分)(1)HgS和O2; 6
(2)O2; Hg2(NO3)2; 4OH—→O2↑+2H2O+4e—
(3)A
三、(请从23、24两小题中任选一题作答,每小题8分。若两小题都做,只按23小题计分)
23.(每空1分,共8分)
![]()
![]() (1)CH3CHO; [ CH2—CH2 ]
(1)CH3CHO; [ CH2—CH2 ]
(2)加成反应;消去反应
(3)CH3CH2Br+H2O CH3CH2OH+HBr
(或CH3CH2Br+NaOH →CH3OH2OH+NaBr)
|
CH3 = CHCOOH + CH3CH2OH CH2 = CHCOOCH2CH3+H2O
|
(4)
24.(每空1分,共8分)(1)Na;O;C
(2)离子 Na+ O2—2
(3)直线型 分子 4个σ键