08届高三化学三月随堂考试题(一)
一、选择题(本题包括18小题,每小题3分,共54分)
1.“E85”是含乙醇85%的乙醇汽油。科学家最近的研究表明,大量使用“E85”可能导致大气中O3含量上升,将会对人体造成更直接的伤害。寻找化石燃料新的替代能源又成为化学工作者研究的新课题。下列各项中正确的是
A.“E85”是由两种物质组成的混合物 B.推广使用乙醇汽油是为了减少温室气体排放
C.等质量的“E85”和汽油充分燃烧后放出的能量相等 D.O3与O2互为同素异形体
2.绿色化学是从源头上防止污染产生或将化学过程对环境的负面影响降低到最低限度的化学。不仅化工生产应遵循绿色化学的原则,化学实验也应遵循绿色化学原则,实现原料和过程的绿色化。下列实验或实验过程遵循绿色化学原则的是
A.用多量的氯气进行性质实验 B.用双氧水代替高锰酸钾制氧气
C.用溴水代替碘水进行萃取实验 D.用铜粉代替铜丝进行Cu和浓HNO3的反应
3.下列物质之间的转化符合“甲![]() 乙
乙![]() 丙
丙![]() 丁”的组合是
丁”的组合是
① Na→NaOH;② Cu→Cu(OH)2;③ S→H2SO4;④ CH3OH→HCOOCH3。
A.①③ B.②④ C.①②④ D.①③④
4.1mol物质中含有的粒子数约为6.02×1023。下列叙述中正确的是
A.室温下,22.4L乙烷和乙烯的混合气体中含有的C原子数约为6.02×1023
B.标准状况下,11.2LCCl4含有的分子数约为0.5×6.02×1023
C.常温常压下,17gH2O2中含有的中子数约为8×6.02×1023
D.0.5L0.5mol/L的NaNO3溶液中含有的粒子总数约为0.5×6.02×1023
5.下列物质:1Cl22Na 3Na2O2 4NO2分别与水反应,氧化剂与还原剂的物质的量之比为1:1的是 A、 12 B、23 C、123 D、1234
6.在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是
A.K+、Al3+、H2PO4—、SO42- B.Ca2+、NH4+、CO32-、Cl-
C.Na+、K+、NO3-、ClO- D.Na+、Ba2+、I-、SO32-
7.对胶体的下列叙述不正确的是
A.加电解质可使某种胶体聚沉,这是中和胶体粒子所带电荷的缘故
B.胶体粒子在直流电场中做定向移动,这是胶体粒子选择性吸附离子而带电荷的缘故
C.一束光线通过胶体时有丁达尔效应,这是胶体粒子对光散射的缘故
D.将溶质为1 mol的FeCl3饱和溶液滴入沸水中,制得的分散系中含Fe(OH)3胶体粒子数为NA
8.下列说法不正确的是
A、任何化学反应都伴随有能量变化
B、反应物总能量低于生成物的总能量时,该反应不能发生
C、反应物总能量高于生成物总能量时,发生放热反应
D、化石燃料在地球上的蕴藏量是有限的,而且又都是非再生能源
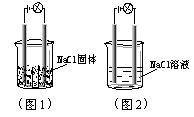 9.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
9.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
10.下列各组溶液中所含溶质的物质的量相等,将其充分混合后不会产生沉淀的是
A、CaCl2、NaHCO3、KOH B、MgCl2、Ba(OH)2、HCl
C、FeCl3、H2S、HCl D、NaAlO2、K2CO3、NH3·H2O
11.Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中都有气体放出。下列说法正确的是
A、都是氧化还原反应 B、CaC2, Mg3N2与水反应属于复分解反应
C、Na2O2,CaH2与水反应,水作氧化剂 D、CaH2与水反应产生H2,它只是氧化产物
12.下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换另一烧杯将上层液体从分液漏斗下口放出 |
 13.某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
13.某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:
则符合上述条件的酯的结构有
A.2种 B.4种 C.6种 D.8种
14.一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:
2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
A.若升高温度,X的体积分数增大,则该反应的△H>0
B.将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C.以X浓度变化表示的反应速率为0.001mol/(L·S)
D.若增大压强,则物质Y的转化率减小
15.下列各溶液中,各离子组一定能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.滴加无色酚酞试液后变红色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
C.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、C6H5O-、Na+、K+
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、HS-
16.草酸是二元中强酸,草酸氢钠溶液显碱性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L
B.V(NaOH)<10 mL时, c(Na+)=![]()
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时, ![]()
17.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.一定存在C1—离子 D.不能确定HCO3-离子是否存在
 18.三容器内分别装有相同压强下的NO、NO2、O2,设三容器容积依次为V1、V2、V3,若将三气体混合于一个容积为V1 + V2 +V3的容积中后,倒立于水槽中,最终容器内充满水。则V1、V2、V3之比不可能是
18.三容器内分别装有相同压强下的NO、NO2、O2,设三容器容积依次为V1、V2、V3,若将三气体混合于一个容积为V1 + V2 +V3的容积中后,倒立于水槽中,最终容器内充满水。则V1、V2、V3之比不可能是
A.3∶7∶4 B.5∶7∶6 C.7∶3∶6 D.1∶1∶1
二、非选择题(本题包括6小题,共46分)
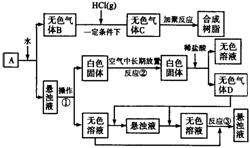
19.(9分)从固体物质A开始,可以发生如下框图所示的一系列变化:完成下面问题:
 (1)在实验室中收集气体B的方法是
。
(1)在实验室中收集气体B的方法是
。
(2)操作①的名称是 。
在操作①中所使用的玻璃仪器的名称是 。
(3)写出反应②和反应③的化学方程式:
反应② ,
反应③ 。
(4)A的化学式是 。
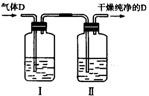
(5)在实验室中,如要获得干燥纯净的气体D,可以将它通过如上图所示的装置,其中瓶I中盛放的试剂是 ,瓶Ⅱ中盛放的试剂是 。
收集干燥气体D的方法是 。
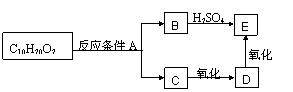
20.(7分)已知:2Fe3+ + 2I- = 2Fe2+ + I2 2Fe2+ + Br2 = 2Fe3+ + 2Br-(不考虑氯气与I2的反应)
(1)如果向含有1molFeI2和2molFeBr2的溶液中通入3molCl2,则被氧化的离子是 ,其对应的氧化产物的物质的量分别是 。反应的离子方程式为 。
(2)若向含有amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Br-、Fe2+完全被氧化时, c为 (用含a、b的代数式表示)
21.(8分)现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示。填写下列空白:
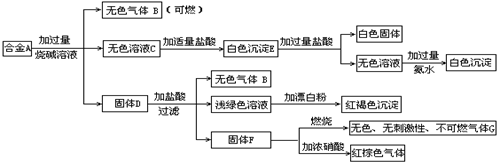
(1)A中含单质为为 (写化学式);G的电子式为 。
(2)写出A中的某单质与烧碱溶液反应的离子方程式______ .
(3) 写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目
。
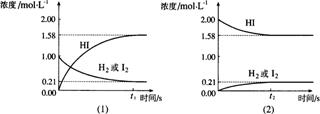 22.(6分)在425℃时,在1升密闭容器中进行的反应 H2(g)+I2(g)
22.(6分)在425℃时,在1升密闭容器中进行的反应 H2(g)+I2(g)![]() 2HI(g) 达到平衡,分析下面示意图后,
2HI(g) 达到平衡,分析下面示意图后,
(1)从下列选项中选出能从示意图中读出相关信息的选项_____(填选项号)
(2)除(1)选出的选项,还能从示意图读出的信息是______________________。
A.同温同压下,从正、逆方向都可以建立平衡。
B.同温下,当三种物质状态为气态时,压强改变对平衡无影响 。
C.此可逆反应的正反应进行程度更深 ,正反应方向为主要反应。
D.当三种物质状态为气态时,温度改变但气体体积不变。
E.![]() HI :
HI :![]() :
:![]() =2:1:1
=2:1:1
F.相同条件下,分别从正、逆方向建立等同的平衡状态,所须时间可能不同。
23.(8分)已知连接羟基的碳原子上没有氢原子的醇不能发生催化氧化反应。A是一种重要的化工原料,其分子组成为C4H9Cl,A有如下转化关系:
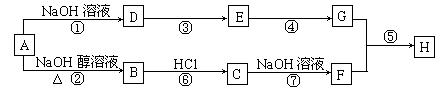
其中F不能发生催化氧化反应,E和G都能和新制Cu(OH)2反应,但反应条件实验现象不同,H是一种有果香味的液体。
(1) A的同分异构体有_____种,符合条件的结构简式为_______________。
(2) 与①、⑦反应类型相同的是_______(填序号,后同),若A中混有C,则对生成的B的纯度是否有影响______(填“是”或“否”),理由是
(3) 写出下列反应的化学方程式:
D→E: ;
G+F→H: 。
24.(8分)将一定质量的铁粉加入到装有100 ml某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 ml(标准状况下)。
①所得溶液中的溶质的化学式是______________;
②原硝酸溶液的物质的量浓度为:________________ mol/L。
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ____________ ;
②m-n的值为(计算精确到0.1g)____________ g 。
1.D 2.B 3.A 4.C 5.C 6.C 7. D 8.B 9.C 10.D 11.B
12.C 13.B 14.C 15.B 16.D 17.B 18.B
19.(9分)(1)排水集气法
(2)过滤;漏斗、玻璃棒、烧杯
(3)Ca(OH)2+CO2=CaCO3↓+H2O;Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O
(4)CaC2
(5)饱和碳酸氢钠溶液,浓硫酸。向上排空气法
20.(7分) (1)I-、Fe2+ 、Br- 1mol 3mol 0.5mol(2)1.5 (a + b)
21.(8分)(1)Fe、Al、Si、C (2×4=8分) ![]() (2分)
(2分)
(2)2Al +2OH-+2H2O=2AlO2-+3H2↑ (2分)
![]() (3)
(3)
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O (3分)
22.(6分)(1)ABCE(4分)
(2)相同条件下,分别从正、逆方向建立等同的平衡状态,所须时间可能不同。(2分)
23.(8分)(1) 4,(CH3)2CHCH2Cl;
![]() (2)⑤,否,A、C的消去反应产物相同(A、C的消去反应产物均为(CH3)2C=CH2)
(2)⑤,否,A、C的消去反应产物相同(A、C的消去反应产物均为(CH3)2C=CH2)
(3) 2(CH3)2CHCH2OH+O2 2(CH3)2CHCHO+2H2O,
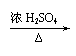 |
CH3CH(CH3)COOH+(CH3)3COH CH3CH(CH3)COOC(CH3)3+H2O。
24.(8分)⑴ ①Fe(NO3)2 ② 0.8 ⑵ ①FeSO4 ② 5.0