08届高中毕业班化学质量检查试题
化 学 试 题
(满分:lOO分 考试时间:90分钟)
注意事项:
本试卷分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷4页为选择题,第Ⅱ卷4页为非选择题。
相对原子质量:H 1 N 14 O 16 P 31 S 32 Cl 35.5
第Ⅰ卷(选择题共45分)
一、选择题(本题包捂15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.下列变化中,一定不存在化学能与热能相互转化的是( )。
A.铝热反应 B.金属钝化 C.燃放爆竹 D.干冰气化
2.下列说法正确的是( )。
A.Na+、NO3一、SO42一、Ba2+在水溶液中能大量共存
B.12C和14C互为同位素
C.NH3分子呈正四面体空间构型
D.C(石墨,s)= C(金刚石,s);△H>0,说明金刚石比石墨稳定
3.下列物质的溶液经加热蒸干并充分灼烧,最终只得到该物质固体的是( )。
A.氯化铵 B.氯化铜 C.碳酸氢钠 D.硫酸钾
4.实验室中,有关试剂的保存方法错误的是( )。
A.烧碱溶液保存在带玻璃塞的试剂瓶中
B.液溴用水封保存
C.少量金属钠保存在煤油中
D.浓硝酸保存在棕色细口瓶中
5.NA表示阿伏加德罗常数,下列叙述正确的是( )。
A.2.24 L CO2中含有的原子总数为0.3NA
B.O.5 mol·L一1 CuCl2溶液中含有0.5 NA个Cu2+
C.一个Cl原子的质量是![]() g
g
D.Al与NaOH溶液反应,每生成1mol H2,Al失去2 NA个电子
6.分别往含有下列离子的溶液中通人氯气,离子浓度不会减少的是( )。
A.H+ B.HC03一 C.Fe2+ D.Ag+
7.日常生活中常用到化学知识,下列说法不正确的是( )。
A.赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色
B.聚氯乙烯塑料有毒,不可用于制食品包装袋
C.明矾溶于水生成的Al(OH),胶体,可除去水中的悬浮颗粒等杂质
D.新制的Cu(OH)2可以测定糖尿病患者尿中萄葡糖的含量
8.下列离子方程式正确的是( )。
A.电解饱和食盐水:Cl一+H2O = OH一+H2↑+Cl2↑
B.用食醋除去热水瓶胆水垢:2H++Mg(OH)2 = Mg2++2H2O
C.用氯化铁溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
D.用胃舒平[含Al(OH)3]治疗胃酸(含盐酸)过多症:
Al(OH)3+3H+ =Al3++3H2O
9.下列有关比较中,错误的是( )。
A.热稳定性:NH3>PH3>H2S
B.熔点:石英>食盐>冰
C.酸性:醋酸>碳酸>苯酚
D.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
10.酸性高锰酸钾溶液与草酸溶液反应的化学方程式为:
2KMnO4+3H2SO4+5H2C2O4 = K2SO4+2MnSO4+10CO2↑+8H2O
不能使反应速率加大的措施是( )。
A.增大酸性高锰酸钾溶液的浓度
B.增大草酸溶液的浓度
C.增大压强
D.升高温度
11.下列实验方案不合理的是( )。
A.用分液法分离苯和四氯化碳的混合液
B.用焰色反应鉴别NaCl和KCl
C.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸和乙醇
D.用KSCN溶液检验FeCl2是否已被氧化而变质
12.下列各组物质发生反应时,生成物不因反应条件(浓度、温度或催化剂)的不同而不 同的是( )。
A.Cu与HNO3 B.C2H5OH与O2
C.Na与O2 D.SO2与O2
|
P4+3KOH+3H2O = PH3↑+3KH2PO2
被氧化的P与被还原的P的质量之比为( )。
A.1∶2 B.2∶l
C.3∶l D.1∶3
14.如右下图所示,试管①中盛有96℃的水,试管②中充满气体B,将液体A滴人试管② 中,充分反应后打开夹子K,发现试管①中的水立刻沸腾。则A与B可能是( )。
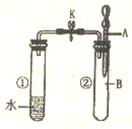 A.水与氮气
A.水与氮气
B.稀硫酸与一氧化碳
C.饱和食盐水与氯气
D.浓氢氧化钠溶液与二氧化碳
15.下列溶液一定呈中性的是( )。
A.将pH=5的盐酸稀释100倍所得到的溶液
B.等物质的量的强酸和强碱反应后所得到的混合溶液
C.c(H+)=c(OH一)=1×10一6mol.L一1的溶液
D.非电解质溶于水得到的溶液
2008年福建省普通高中毕业班质量检查
化 学 试 题
第Ⅱ卷(非选择题共55分)
二、(本题包括2小题.共18分)
16.(5分)用下图所示装置进行实验。
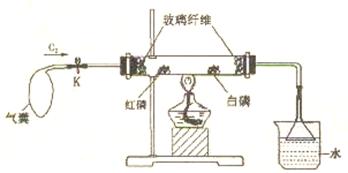
实验步骤:检查气密性;装入少许白磷、红磷;打开夹子K,通入氧气;点燃酒精灯
(加热位置如图所示)。
(1)该实验主要用于比较白磷和红磷的___________,还能证明“磷能在氧气中燃烧”。在硬质玻璃管中可以观察到有__________(填“白烟”或“白雾”)生成。
(2)该实验符合化学实验设计“环保策略”,主要体现在:
_______________________________________________________________
17.(13分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
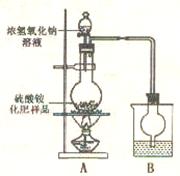

新华中学化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观]该硫酸铵化肥无可见机械杂质。
[实验探究]按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:
_______________________________________
烧杯中最适宜盛放的试剂是__________(填“浓硫酸”、“稀硫酸”或“水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是_______________________________
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的氮含量可能偏高,因为实验装置 中存在一个明显缺陷是:____________________________________________________
乙同学:实验装置中还存在另一个明显缺陷是:____________________________
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验前后B装置增重3.40g。该化肥_________(填“是”或“不是”)一等品。
三、(本题包括2小题,共22分)
|
它们的质子数之和为21。
(1)氢元素与Z形成原子个数比为1∶1的化合物,其电子式为_____________。
该化合物分子中存在__________(填“共价键”或“离子键”)。
(2)Y最高价氧化物的水化物与Y的氢化物恰好完全反应时,生成物的水溶液呈酸 性,其原因是_________________________________________;
该溶液中各种离子浓度由大到小顺序为______________________________。
(3)恒温恒容下,2mol H2与2mol Y的单质反应,达到平衡时,Y的单质为1.8mol, H2的转化率为__________;若该反应在恒温恒压条件下进行(其它条件相同),反应达到平衡时,H2的转化率比上述条件下H2的转化率_______(填“大”、“小”或“相同”)。
(4)由X的最简单气态氢化物、Z的单质和KOH溶液组成的新型燃料电池中,正极 上发生反应的电极反应式为__________________________________________。
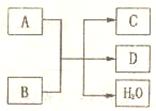 19.(8分)A、B、C、D均为中学化学常见的物质。
19.(8分)A、B、C、D均为中学化学常见的物质。
(1)当A、B、C、D之间存在如右图所示的转化关系时。
①若A为Cl2,B为Ca(OH)2,反应的化学方程式为:
______________________________________
②若A为单质,C、D均为能使澄清石灰水变浑浊的气体。B的化学式为______________。
(2)若A、B、C、D中都含有同一种元素,D为空气中的主要成分之一,写出一个符合A+B→C+D反应关系的化学方程式:____________________________________________
四、(本题包括l小题。共15分)
20.(15分)肉桂酸甲酯(![]() )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯的分子式是____________________。
(2)有关肉桂酸甲酯的叙述中,正确的是___________________(填标号)。
A.能与溴的四氯化碳溶液发生加成反应 B.无法使酸眭高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.不可能发生加聚反应
![]() (3)G为肉桂酸甲酯的一种同分异构体,其分子结
(3)G为肉桂酸甲酯的一种同分异构体,其分子结 构模型如右图所示(图中○、●、 表示不同的原子,连线表示原子问的共价键)。G的结构简式为__________。
构模型如右图所示(图中○、●、 表示不同的原子,连线表示原子问的共价键)。G的结构简式为__________。
(4)用芳香烃A为原料合成G的路线如下:
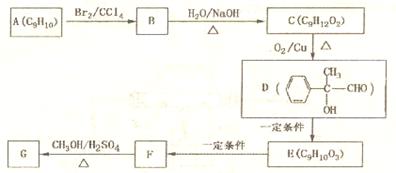
①化合物E中的官能团有______________(填名称)。
②B→C的反应类型是______________,该反应的化学方程式为:
_____________________________________________________________
③写出符合下列条件的F的同分异构体的结构简式:______________________
i.分子内含苯环,且苯环上只有一个支链;
ii.一定条件下,1mol该物质与足量的银氨溶液充分反应,生成4mol银单质。
化学试题参考答案及评分标准
总说明:
1.本答案供阅卷评分时使用.考生若写出其它正确答案。可参照评分标准给分。
2.化学方程式、离子方程式未配平的。都不给分。
一、(每小题3分,共45分)
1.D 2.B 3.D 4.A 5.D 6.A 7.A 8.D 9.A 10.C
11.A 12.D 13.C 14.D 15.C
16.
(1)着火点 (2分)
白烟 (1分)
(2)不易污染环境 (2分)
(或实验中有关的化学反应均在密闭装置中进行等合理答案)
17.
(1) ![]() (3分)
(3分)
稀硫酸 (1分)
(2)使硫酸铵充分反应完全转化为NH3 (3分)
[交流讨论]
A、B装置间缺一个干燥装置 (2分)
缺少赶尽反应装置中残留氨气的装置 (2分)
[探究结论]
不是 (2分)
三、
18.(1)![]() (2分)
(2分)
共价键 (1分)
(2)![]() (2分)
(2分)
(或其它合理答案)
![]() (2分)
(2分)
(3)30%;大 (各2分,共4分)
(4)![]() (3分)
(3分)
|
(1) (3分)
(2分)
(2) (3分)
四、
20.
(1)C10H10O2 (2分)
(2)A、C (2分)
(3) ![]() (2分)
(2分)
(4)①羧基、羟基 (2分)
②取代反应 (2分)
(或水解反应)
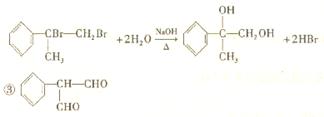 |
(3分)
(2分)