高三化学上学期第一次月考考试试题
1. 本卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
2. 答题前,考生务必将自己的班级、姓名、考试号填写在试卷指定位置。
第Ⅰ卷 选择题(共48分)
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个正确答案):
1.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前,中、美、日等国掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
2.美国科学家用有机分子和球形笼状分子C60,首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进入一个新阶段
C.C60是一种新型化合物
D.C60熔点比金刚石熔点高
3.氕化锂、氘化锂、氚化锂可以作为长征2号火箭发射的重要燃料,下列说法正确的是
A.H、D、T之间互称同素异形体 B.氕化锂、氘化锂、氚化锂起催化剂作用
C.LiH、LiD、LiT的摩尔质量之比为1﹕2﹕3 D.它们都是强还原剂
4. 有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质对应水溶液均是强酸
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
5. 阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是
A.标准状况下,3.01×1023个CCl4所占的体积不等于11.2 L
B.80 g NH4NO3晶体中约含有NH4+ 6.02×1023个
C.3.9 gNa2O2吸收足量的CO2时转移的电子数约是6.02×1022
D.46 g NO2和N2O4混合气体中含有原子数约为1.806×1024
6. 下列各组变化中,化学反应的反应热前者大于后者的一组是
①CH4 (g)+2O2 (g) = CO2 (g)+2H2O (1) △H1 ; CH4 (g)十2O2 (g) = CO2 (g)+2H2O (g) △H2
②2H2 (g)+O2(g)
= 2H2O (1)
△H1 ; H2 (g)+![]() O2
(g) = H2O (1)
△H2
O2
(g) = H2O (1)
△H2
③t℃时,在一定条件下,将1mol SO2和1mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应热效应分别为△H1、△H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 ; CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.①②③ B.②④ C.②③④ D.③④
7. 下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Ca2+、AlO2—、SO42-、Cl- B.K+、ClO-、Cl-、NO3-
C.Na+、K+、NO3- SO42- D. NH4+、Na+、F-、CO32-
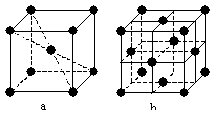 8. 在1183 K以下纯铁晶体的基本结构单元如a所示,在1183 K以上转变为b所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。下列说法正确的是
8. 在1183 K以下纯铁晶体的基本结构单元如a所示,在1183 K以上转变为b所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。下列说法正确的是
A.a型属于CsCl晶胞,b型属于NaCl晶胞
B.纯铁由于存在两种晶胞,因此它有两种不同的熔点
C.a型中的铁原子表面利用率高于b型,
D.上述纯铁晶体转变温度(1 183 K以下和以上)前
后两者的密度比![]()
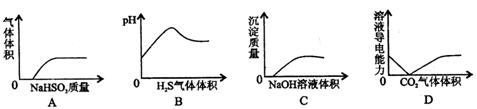 9. 下列实验过程中,产生的相关变化与对应的图形相符合的是
9. 下列实验过程中,产生的相关变化与对应的图形相符合的是
A.NaHSO3
粉末加入HNO3溶液中 B.H2S 气体通入氯水中
C.NaOH 溶液滴入Ba ( HCO3)2溶液中 D . CO2气体通入澄清石灰水中
10. 2004年,美国科学家通过"勇气"号太空车探测出火星大气中含有一种称为羰基硫(化学式为COS)的物质。已知硫基羰分子中所有原子最外层均满足8电子结构。下列说法正确的是
A.羰基硫是酸性氧化物
B.羰基硫结构式为S=C=O
C.羰基硫属于非极性分子
D.羰基硫为分子晶体,沸点比CO2低
11. 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断不正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有三个氧化还原反应
C.实验①生成的气体能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
12.下列物质不能由化合反应得到的是
A.FeCl3 B.Fe(OH)3 C. Fe(OH)2 D.FeCl2
13.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
14. 下列有关叙述中正确的是
A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.由碳、氮原子形成的化合物比金刚石坚硬,其主要原因是碳氮键比碳碳键更短
C.S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物
D.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+10
15. 下列有关比较中,大小顺序排列错误的是
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰>汞
C.结合质子的能力:CO32- >CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
16. 下列离子方程式正确的是
A.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7 Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 2Fe2+ + 2H+ + H2O2 =2 Fe3+ + 2H2O
D.向NaHCO3 溶液中加入过量Ca(OH)2 溶液 2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32-
第Ⅱ卷 非选择题(共52分)
二、实验题(本题共1小题,共22分)
17. (8分)试回答下列问题:
(1)量筒内液体体积正确读数为10.0mL时,全部倒入烧杯内的实际体积______10.0mL;100mL容量瓶内液面正好达到刻度线,全部倒入烧杯内的实际体积________100mL。(填:大于、等于或小于)
(2) 中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_________、_____________。
(3) 欲量取20.00mL Na2CO3溶液,应选用的仪器是_____________________。
(4)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行______次。
18. (14分)某化学研究性学习小组讨论Fe3+和SO32—之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32—+H2O=2Fe2++SO42—+2H+;
二是发生双水解反应:2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
【实验Ⅰ】学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是 。
【实验Ⅱ】取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生血红色现象的离子方程式是 。
【实验Ⅲ】换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
三、填空题(本题共3小题,共30分)
19. (8分)(1)某反应池中,发生“生物硝化过程”,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:
NH4++ O2→ NO3-+ H++ H2O
①配平上面化学方程式,将系数填入方框中。
②将铵态氮中的1mg氮转化成硝酸根中的氮,需氧气_________毫克。
(2)3级反应池中发生的“生物反硝化过程”,通常需要外加甲醇,净反应如下所示:
NO3-+5CH3OH→ N2+ CO2+ H2O+ OH-
配平上面化学方程式,将系数填入方框中。
 20、(14分) 甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
20、(14分) 甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
甲、乙是同一类晶体中的各自结构单元,单质甲能与乙发生置换反应,丙、丁、戊三种粒子含有等量的电子数,其中丙、丁是同一类晶体中的分子或分子集团,常温下丁呈液态,能产生两种等电子数的粒子,戊是阳离子。
(1)写出液态丁产生两种等电子粒子的电离方程式:
(2)室温下含有戊的盐溶液,其pH 。
A.>7 B.=7 C.<7 D.以上都有可能
(3)丙是目前重要的能源
①丙和丁在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其正极反应的电极方程式为
(4)甲、乙高温反应时,甲被破坏了1 mol共价键,则参加反应的乙为 g。
21.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
高三化学答题纸
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个正确答案)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
二、实验题(本题共2小题,共22分)
17.(1) ; (填:大于、等于或小于)
(2) ;
(3)
(4)
18. 【实验Ⅰ】
【实验Ⅱ】
。
。
【实验Ⅲ】 。
。
①________________________________________________________________;
②________________________________________________________________。
三、填空题(本题共3小题,共30分)
19.(1)① NH4++ O2→ NO3-+ H++ H2O
② 毫克
③ NO3-+5CH3OH→ N2+ CO2+ H2O+ OH-
20.(1)
(2)
(3) ①
②
(4) g
21.(1)
(2) 、
(3) mol。
高三化学参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| C | B | D | D | C | D | B | D | D | B | D | C | B | B | A | C |
17. (8分)
⑴等于;小于。(各1分)
⑵量筒、环形玻璃搅拌棒(各1分)
⑶碱式滴定管。(2分)
(4) 4 (2分)
18. (14分)
实验Ⅰ:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)(2分)
实验Ⅱ:氢氧化铁胶体(或胶体);(2分)
先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色;有气泡产生;(2分)
Fe3+ + 3SCN—=Fe(SCN)3(2分)
实验Ⅲ:Fe3+与SO32—同时发生氧化还原反应和双水解反应;(2分)
2Fe3++3CO32—+3H2O=2Fe(OH)3↓+3CO2↑(2分)
①SO32—有较强的还原性,CO32—没有还原性;(1分)
②SO32—水解能力较CO32—小(1分)
19. (8分)
① 1 NH4++ 2 O2→ 1 NO3-+ 2 H++ 1 H2O (2分)
② 4.57 毫克 (2分)
③ 6 NO3-+5CH3OH→ 3 N2+ 5 CO2+ 7 H2O+ 6 OH- (2分)
20. (14分)
(1) 2H2O![]() H3O++OH-(3分)
H3O++OH-(3分)
(2) D(3分)
(3)① CH4+H2O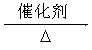 CO+3H2 (3分)
CO+3H2 (3分)
②O2+2H2O+4e-=4OH― (3分)
(4) 15g。(3分)
21. (1) 14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O
(2)酸性 氧化性
(3)0.6mol