高三化学八月模拟考试试题
化 学 试 卷
可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Cl:35.5
Na:23 Mg:24 Al:27 Ca:40 Fe:56 Cu:64
第一部分 选择题 (共70分)
一、单项选择题(本题包括10小题,每小题3分,共30。每小题只有一个选项符合题意)
1.“神舟”五号载人飞船发射成功后,我国又在启动“嫦娥工程”,在3-4年内中国人登上月球。人类探测月球发现,其土壤中存在较丰富的质量数为3的氦,它可以作为核聚变的重要原料之一。以下叙述正确的是( )
A.由质量数为3的氦原子构成的分子是双原子分子
B.23He与24He的性质均相同
C.23He、24He 形成的分子中存在共价键
D.23He中的质子数与24He的中子数相等
2.下列产品的使用不会对环境造成污染的是
A.含磷洗衣粉 B.酒精 C.氟利昂 D.镍镉电池
3.下列“反应”中不是化学变化的是
A.显色反应 B.焰色反应 C.颜色反应 D.水解反应
4.在一定的温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来的温度,下列说法正确的是
A.溶液中溶液中Na+浓度增大,有O2放出
B.溶液中OH-总数不变,有O2放出
C.溶液的pH增大,有O2放出
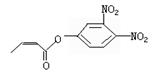
D.溶液中Na+总数减少,有O2放出
5.下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由温度不同而引起的是
①Na+O2 ②P+ Cl2 ③ C2H5OH+ H2SO4 (浓) ④Cu+HNO3 ⑤CO2+NaOH ⑥C2H2+HCl ⑦Fe+ H2SO4 ⑧Cl2+NaOH
A.①③⑧ B.②⑤⑦ C.③④⑧ D.②③⑥
6.下列各组物质的分类,正确的是
A.同位素:金刚石、石墨、C60 B.非电解质:Cl2、NH3、C2H5OH
C.含极性键的分子:CO2、CCl4、NH3 D.同系物:![]() 、
、![]() 、
、![]()
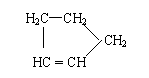
7.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g)+Cl2(g)=2HCl(g); △H=-184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g); △H=-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l); △H=-571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g); △H=-283kJ/mol
8.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸钠溶液中滴加稀硫酸 B.氯化铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.酸性高锰酸钾溶液中滴加亚硫酸钠溶液
9. 某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是:
A.Cl-、Mg2+、H+、Cu2+、SO![]() B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH![]() 、SO
、SO![]()
C.K+、NO![]() 、SO
、SO![]() 、H+、Na+ D. MnO
、H+、Na+ D. MnO![]() 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO![]()
10.反应速度V和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速度V可表示为V=K![]() 式中K为常数,m、n值可用下表中数据确定之。
式中K为常数,m、n值可用下表中数据确定之。
|
|
| V(mol/L·s) |
| 1.0 | 1.0 | 1.0K |
| 2.0 | 1.0 | 2.0K |
| 2.0 | 4.0 | 4.0K |
由此可推得,m、n值正确的是
A.m=1、n=1 B.m=![]() 、n=
、n=![]() C.m=
C.m=![]() 、n=1 D.m=1、n=
、n=1 D.m=1、n= ![]()
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。 若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
![]()
![]()
![]() 11.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
11.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
![]()
![]() A.C
CO
CO2
Na2CO3
A.C
CO
CO2
Na2CO3
![]()
![]() B.Cu Cu(NO3)2溶液 Cu(OH)2
B.Cu Cu(NO3)2溶液 Cu(OH)2
![]()
![]() C.Fe Fe2O3 Fe2(SO4)3溶液
C.Fe Fe2O3 Fe2(SO4)3溶液
D.CaO Ca(OH)2溶液 NaOH溶液
12.现有三组实验:① 除去混在植物油中的水 ② 回收碘的CCl4溶液中的CCl4
③ 用食用酒精浸泡中草药提取其中的有效成份。分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
13.下列离子方程式中,正确的是
A.在氯化亚铁溶液中通入氯气Fe2++Cl2====Fe3++2Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3·H2O====Fe(OH)3↓+3![]()
C.碳酸氢钙溶液跟稀硝酸反应Ca(HCO3)2+2H+====Ca2++2H2O+2CO2↑
D.偏铝酸钠的水溶液显碱性:![]() +2H2O
+2H2O![]() Al(OH)3+OH-
Al(OH)3+OH-
14.设NA表示阿伏加德罗常数,下列说法中不正确的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
15.为了说明盐类水解是吸热反应,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是:
A.将CH3COONa·3H2O晶体溶于水,温度降低
B.醋酸钠水溶液的PH值大于7
C.醋酸钠溶液滴入酚酞是红色,加热后颜色变深
D.醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气
16.若某池(电解池或原电池)的总反应离子方程式是: Cu+2H+= Cu2+ +H2↑,关于此池的有关说法正确的是:
A.该池只能是电解池,且金属铜为该电解池的阳极
B.该池只能是原电池,且电解质溶液为硝酸
C.该池可能是原电池,也可能是电解池
D.该池只能是电解池,电解质溶液可以是硝酸
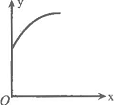 17.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)
17.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g);ΔH<0。达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);ΔH<0。达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
| X | Y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 缩小体积 | A的转化率 |
| D | 升高温度 | 混合气体密度 |
18. 已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10—8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10—5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3—) >c (Cl—) >c (Ag+)>c (I—)
B.c (K+)>c (NO3—) >c (Ag+) >c (Cl—)>c (I—)
C.c (NO3—)>c (K+)>c (Ag+) >c (Cl—)>c (I—)
D.c (K+)>c (NO3—) >c (Ag+) = c (Cl—) + c (I—)
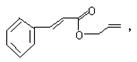 19.对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯:
19.对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯:
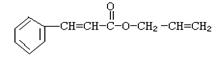 可简化为
可简化为
|
杀虫剂“阿乐丹”的结构表示为 ,若它在稀酸作用下
能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.遇FeCl3溶液均显紫色 B.均能发生银镜反应
C.均能与溴水发生反应 D.均能与NaOH溶液发生反应
20. 4.下列实验装置图完全正确的是
4.下列实验装置图完全正确的是
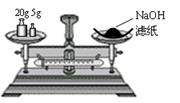
A.称量氢氧化钠固体 B.配制150mL0.10mol/L盐酸
| |
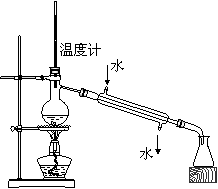
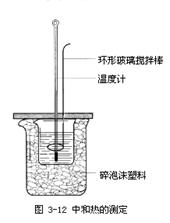
C.测定中和热 D.分离苯和甲苯
第二部分 非选择题 (共80分)
三、(本题包括3小题,共29分)
21.(7分)(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、 普通漏斗、玻璃棒、烧杯。
①若要进行中和滴定实验,还缺少的玻璃仪器是 ;
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是 ;
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水。
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色。
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号) 。
22.(10分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少
 量气泡产生,溶液浅黄绿色褪去;
量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因是______ _______________ ________ 。
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___。
实验二、定量研究:
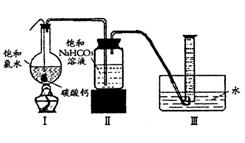 在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现![]() 明显小于
明显小于![]() 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是________ ________ 。
 23.(12分)下面是关于硫化氢的部分文献资料
23.(12分)下面是关于硫化氢的部分文献资料
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
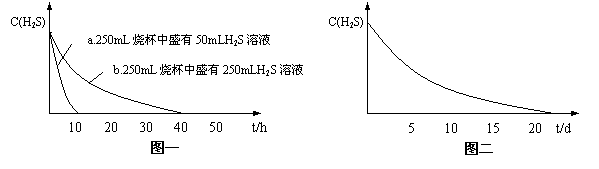
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
 实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
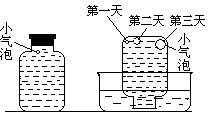
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
 (1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为__________ 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应______
_______ 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____ __的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)________________ ______。此实验中通入空气的速度很慢的主要原因是什么?___________________ ____________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是____ _____。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?______________________ _______________。
四、(本题包括3小题,共31分)
24.(10分)红矾(重铬酸钠Na2Cr2O7)是一种非常重要的工业产品;工业上生产红矾的工艺流程如下:
①铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2)与纯碱、石灰石混合后通过空气焙烧(使铬转化为+6价化合物)
②焙烧产物加水后,并用硫酸调成中性溶液
③过滤、滤液加硫酸酸化、浓缩、结晶成红矾
(1)完成下列化学方程式:
SiO2+CaCO3![]() ;
;
Al2O3+Na2CO3![]() 。
。
(2)配平下列反应方程式,填上系数:
FeO·Cr2O3+ Na2CO3+ O2 ¾ Na2CrO4+ Fe2O3+ CO2
(3)用水浸取焙烧产物,并用硫酸调成中性的目的是
并写出有关的离子方程
25.(9分)地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热,在673K~1123K区间内分解为氧化物,样品总失重13.8mg。
.... ⑴方解石的失重百分比为 。
.... ⑵计算矿物中高岭石的质量分数。
26.(12分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
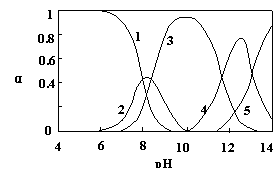
【1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】
⑴Pb(NO3)2溶液中,![]() 2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,
2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,![]() 增加,可能的原因是
。
增加,可能的原因是
。
⑵往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有
,pH=9时,主要反应的离子方程式为 。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
![]() 离子
Pb2+ Ca2+ Fe3+ Mn2+ Cl-
离子
Pb2+ Ca2+ Fe3+ Mn2+ Cl-
处理前浓度/(mg·L-1) 0.100 29.8 0.120 0.087 51.9
处理后浓度/(mg·L-1) 0.004 22.6 0.040 0.053 49.8
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 。
⑷如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+![]() E2Pb(s)+2H+ 则脱铅的最合适pH范围为 (填代号)。
E2Pb(s)+2H+ 则脱铅的最合适pH范围为 (填代号)。
A.4~5 B.6~7 C.9~10 D.11~12
五、(本题包括1小题,共10分)
27.(10分)萨罗(Salol)是一种消毒剂,它的分子式C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键):
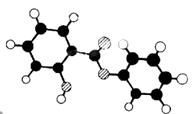
(1)根据上图模型写出萨罗的结构简式:_________________ ______。
(2)写出萨罗分子结构中含有官能团的名称: 。
(3)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸),请判断a.苯酚、b.碳酸、c.水杨酸的酸性强弱(用字母表示)。 。
(4)写出同时符合下列四种条件的水杨酸的同分异构体共有_ ______种。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1mol该同分异构体能与2molNaOH发生反应;
④只能生成两种一氯代产物。
(5)从(4)确定的同分异构体中任选一种,指定为下列框图中的A。
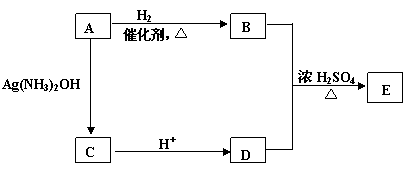

写出下列反应的化学方程式:
B+D→E: ;
该反应属于 反应。
六、(选做题,本题共10分)
考生注意:28、29题为选做题,考生可任选一题。
28.(10分)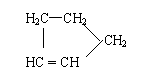
 由题中所给的信息Ⅰ、Ⅱ,结合已学知识,回答下列问题:
由题中所给的信息Ⅰ、Ⅱ,结合已学知识,回答下列问题:
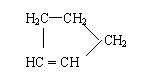 Ⅰ:
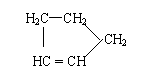
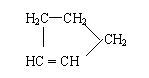
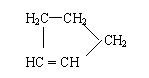
是环戊烯的结构简式,可进一步简写为 。
Ⅰ:
是环戊烯的结构简式,可进一步简写为 。
环戊烯的化学性质跟烯烃相似。
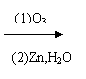 Ⅱ:有机物中烯键可发生如下反应:
Ⅱ:有机物中烯键可发生如下反应:
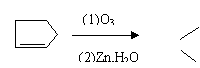 ① (CH3)2C=CHCH3
(CH3)2C=O
+ CH3CH=O
① (CH3)2C=CHCH3
(CH3)2C=O
+ CH3CH=O
CH2CHO
② CH2
CH2CHO
![]() (1)写出异戊二烯(CH2=CH—C=CH2)经O3分解生成的各种产物的结构简式及物质
(1)写出异戊二烯(CH2=CH—C=CH2)经O3分解生成的各种产物的结构简式及物质
CH3
的量之比:
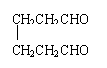 (2)写出由环己醇( )合成己二醛(
)各步反应的化学
(2)写出由环己醇( )合成己二醛(
)各步反应的化学
方程式:
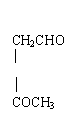
 (3)某烃A的分子式为C10H16。A经O3分解可得到等物质的量的两种产物,其结构简式
(3)某烃A的分子式为C10H16。A经O3分解可得到等物质的量的两种产物,其结构简式
分别为HCHO和CH3COCH2CH2CH 。 A经催化加氢得产物B,B的分子式是C10H20,
且B内含有六元碳环。写出A和B的结构简式。A: B: 。
29.(10分)a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 (单位电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。试写出:
(1) a粒子的核外电子排布式 。
(2) b与e相应元素的最高价氧化物对应水化物的碱性比较为: > (用化学式表示)。
(3) d粒子所构成的物质具有易液化的特性,推测其原因为: 。
(4) g粒子所构成的晶体类型属于 晶体。
(5) c粒子是 ,f粒子是 (用化学式表示)。