高三化学第一学期十校联合体联考试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分为100分;考试时间为90分钟。
可能用到的相对原子质量:H-1 D-2 C-12 N-14 O-16 P-31 Si-28 Mg-24 Al-27 Cu-64
第I卷(选择题 共54分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.禽流感病毒对常用消毒剂十分敏感,容易将其杀灭,如氧化剂、稀酸等都能迅速破坏其活性,下列不能杀灭禽流感病毒的物质是
A.H2O2溶液 B.NaClO溶液 C.矿泉水 D.醋酸
2.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是
A.不易生锈 B.导电性好 C.密度小 D.强度高
3、用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.4 g重水(D2O)中所含质子数为0.2 NA
B.4.48 L N2与CO的混合物所含分子数为0.2 NA
C.6.2 g白磷中所含磷原子数为0.2 NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
4、下列叙述正确的是
A.不能跟酸反应的氧化物一定能跟碱反应
B.同一主族元素的气态氢化物的相对分子质量越大,它的沸点一定越高
C.在CCl4、PCl3、HCl中各原子最外层均能达到8电子的稳定结构
D.升高温度可加快反应速率,其主要原因是反应物分子能量增加,活化分子百分数增加,使有效碰撞次数增多
5、下列实验中,颜色的变化与有关物质的强氧化性无关的是
A.乙烯使酸性高锰酸钾溶液褪色
B.SO2使滴有酚酞的红色NaOH溶液褪色
C.氯气使鲜花褪色
D.过氧化钠使品红溶液褪色
6、下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石):ΔH = +119 kJ· mol—1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-aq)-===H2O(l);ΔH=-57.3 kJ· mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l);ΔH=-285.8 kJ· mol—1
7、一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是有4个硼原子和1个碳原子构成
8、一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g);△H>0,达到平衡状态,现进行如下操作:
2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
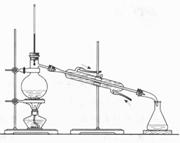 9、以下实验装置一般不用于分离物质的是
9、以下实验装置一般不用于分离物质的是
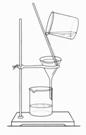 | |||||
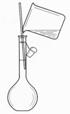 |  | ||||
A. B. C. D.
10、下列四种物质中,只能跟盐酸反应,不能跟烧碱反应的是
A、NaHSO4 B、Na2S C、Al(OH)3 D、NH4Cl
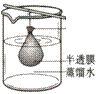
11、在水泥厂和冶金厂中常用高压电对气溶胶作用来除去烟尘,以减少对空气的污染,这种做法所应用的原理是
A、胶体凝聚 B、丁达尔现象 C、电泳 D、渗析
12、下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
A.Cu2+ S2- Br- ClO- B.K+ Ba2+ OH- I-
C.Na+ H+ Cl- NO3- D.Na+ Mg2+ Cl- SO42-
13、航天技术上使用的一种氢氧燃料电池,具有高能轻便,不污染环境等优点,该电池总反应方程式为:2H2+O2 =2H2O, 该电池的正极变化可表示为
A. 4H+ +4 e- =2H2 ↑ B. 4OH--4e- =O2↑+ 2H2O
C.O2 + 2H2O +4e- = 4OH- D. 2H2-4e- = 4H+
14、某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为
A.11.2g B.16.8g C.19.6g D.22.4g
15、某有机物结构简式为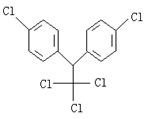 ,有关它的说法正确的是
,有关它的说法正确的是
A.它属于芳香烃 B.分子中最多有22个原子共面
C.分子式为![]() D.1mol该物质能与6mol H2加成
D.1mol该物质能与6mol H2加成
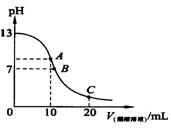
|
A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B.在B点:c(OH-)﹦c(H+),c(Na+)﹦c(CH3COO-)
C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
第Ⅱ卷(非选择题 共52分)
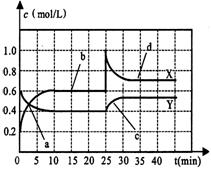 17、(6分)已知NO2和N2O4可以相互转化:2NO2
17、(6分)已知NO2和N2O4可以相互转化:2NO2![]() N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。根据右图,回答下列问题:
N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。根据右图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线 表
示NO2浓度随时间的变化;a、b、c、d四个点
中,表示化学反应处于平衡状态的点是 。
(2)前10min内用NO2表示的化学反应速率
v(NO2) = mol/(L·min);反应进行至25min
时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡状态,在25min
时还可以采取的措施是 。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
|
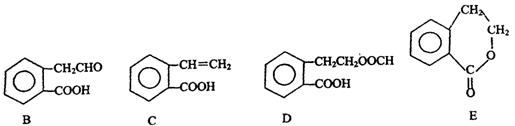
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
|
请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
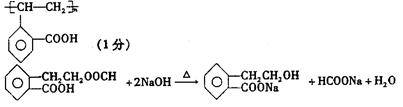
19、(14分)已知有机物A是一种邻位二取代苯,其中一个取代基是羧基,它可发生如下转化:
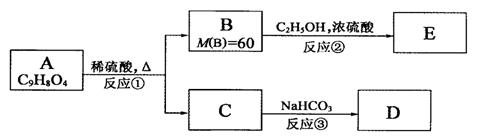
请回答下列问题:
(1)反应①、②都属于取代反应,其中①是 反应,②是 反应(填有机反应名称)
(2)A的结构简式是: 。
(3)反应③的化学方程式是(有机物写结构简式): 。
(4)写出A与NaOH溶液共热的化学方程式(有机物写结构简式):
。
(5)写出三种具有与A相同官能团且均为邻位二取代苯的同分异构体的结构简式:
。
20、(8分)有A、B、C、D四种短周期元素,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,且A、B、C分别与D形成三种化合物分子所含的电子数相等,请回答:
⑴X、Y、Z、W都是由上述元素中的两种组成的化合物,若X分子的空间构型为三角锥型,则X的电子式为 ;已知Y被称为绿色氧化剂,Z与Y具有相同的电子数且经常联合在一起作为火箭推进器的燃料,则Y为 ,Z为 (填化学式),W是中学化学中常见的物质,其分子的空间构型为直线型,且所含有的原子数多于2个,其可能的化学式为 、 (只要写出2个)。
⑵甲、乙、丙都是由上述元素中的三种组成的物质,甲为食品中常见的天然高分子化合物,表示其组成的化学式为
;乙属于无机盐类,其水溶液明显显酸性,则乙的化学式为
;丙与甲的组成元素相同,丙的溶液呈弱酸性,其式量小于80,且其中A的质量分数为![]() ,则丙的结构简式为
。
,则丙的结构简式为
。
21、(8分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是对演示实验改进后的装置(其中a、b、c 为弹簧夹),试回答下列各问:
(1)甲装置中发生反应的离子方程式是 。
(2)和甲装置相比,乙装置的优点是 。
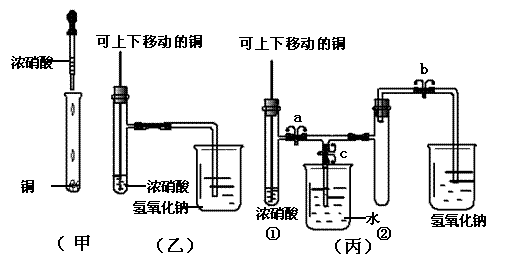
(3)为了进一步验证NO2和水的反应,某同学设计了丙装置。先关闭弹簧夹 (填a、b、c,后同),再打开弹簧夹 ,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作 。
(5)当②试管中的NO2和水充分反应,所得溶液物质的量浓度的最大值是 。(不考虑NO2与N2O4的转化且该实验条件下气体摩尔体积设为Vm L/mol)
22、(8分)2007年国家质检总局铝合金抽检合格率约为90%。已知国家行业标准中铸造铝合金的各成分的质量分数为:Si-4.5%~5.5%,Cu-1.0%~1.5%,Mg-0.4%~0.6%,其余为Al。
现对某品牌的铸造铝合金中所含的四种成分作如下的实验检测:
①称取18.0g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
②待两份反应物都充分反应之后,称得滤渣质量相差0.512g,收集得到的两份气体的体积相差851.2mL(标准状况下)。
试回答下列问题:
⑴样品中Si和Mg的物质的量分别是多少。
⑵通过计算判断该品牌的铸造铝合金是否为合格产品(一项不达标即为不合格产品)
高三联考
化学参考答案及评分标准
(柳市中学高三化学组 叶素央 )
一、(每小题3分,共54分)
1C 2B 3C 4D 5B 6C 7C 8B 9A 10B 11C 12D 13C 14D 15D 16A
二、(共15分)
17.(共6分)
(1)X b和d (2分) (2) 0.04 加入了0.4molNO2 (2分) (3)BD (2分)
18.(8分)(1)消去反应(1分)(2)C和E(1分)
|
(3)O2+2
|
(5)
(6) (2分)
19.(共14分)
(1)水解(1分)酯化(1分)
(2)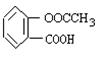 (2分)
(2分)
(3)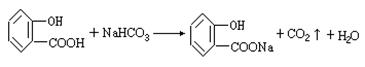 (2分)
(2分)
(4)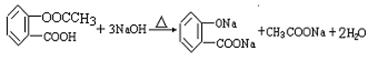 (2分)
(2分)
![]() (5)
(5)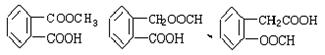 (各2分,共6分)
(各2分,共6分)
20、(8分)⑴ ,H2O2,N2H4, CO2、C2H2、N2O(任写两种)
![]() ⑵(C6H10O5)n
NH4NO3
CH2COOH (每空1分)
⑵(C6H10O5)n
NH4NO3
CH2COOH (每空1分)
五、(共7分)
21.(共7分)
(1)①Cu(NO3)2 (1分) ② 0.4 (1分)
(2)①CuSO4 (1分) ②3Cu+8H++2NO3- = 3Cu2+ +2NO↑+4H2O (2分)
③5.76g( 2分)
22.(8分)⑴设9g样品中所含Si的物质的量为x,Mg的物质的量为y。
![]() 28x-24y=0.512
28x-24y=0.512
2x-y=![]() (4分)
(4分)
解得:x=0.02mol,y=0.002mol(2分)
⑵因为合金中Si的百分含量为:0.02mol×28g/mol÷9g×100%=6.2%,超过国家标准,故该铸造铝合金属于不合格产品。(2分)