高三年级化学上册第四次月考试题
高三化学备课组
本试卷分为第1卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,时间90分钟。
注意事项:
1.第I卷写在答题卡上,第II卷写在卷子上。
2.答题前,考生务必将自己的“姓名”、“班级”和“学号”“座号”写在相应的位置上;
3.考试结束,只交答题卡和第II卷。
4.可能用到的原子量:H-1 O-16 N-14 Al-27 S-32 Na-23 K-39
Ba-137 Ca-40 Cl-35.5 Cu-64
Ⅰ卷
一.选择题(本题包括17小题,每小题3分,共51分,每小题只有一个选项符合题意)
1.勤洗手和经常对环境进行消毒是预防传染病的有效途径。某消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色。则该消毒液的主要成分可能是
A.KMnO4 B.H2O2 C.NaClO D.NH3·H2O
2.二氧化硫能使浸过溴水的滤纸褪色,这说明了:
A、溴的氧化性 B、溴的挥发性
C、SO2的氧化性 D、SO2的漂白性
3.可以判断某一元酸是强电解质的现象是
A、该酸加热至沸腾也不分解
B、该酸可溶解氧化铜
C、该酸可跟石灰石反应,放出CO2
D、该酸浓度为0.01mol·L-1时的pH值为2
![]()
![]() 4.下列金属冶炼的反应原理,错误的是
4.下列金属冶炼的反应原理,错误的是
![]()
![]() A.2NaCl(熔融) 2Na+Cl2↑ B.MgO+H2
Mg+H2O
A.2NaCl(熔融) 2Na+Cl2↑ B.MgO+H2
Mg+H2O
C.Fe3O4+4CO 3Fe+4CO2 D.2HgO 2Hg+O2↑
5.设NA为阿伏加德罗常数,则下列说法正确的是
A.22.4 L乙烯中含有的分子数为NA
B.0.1 L 0.1 mol/L的CH3COOH溶液中含有的醋酸分子数为0.01 Na
C.含0.1 mol H2O2的水溶液跟Mn02充分作用,反应过程中转移的电子总数0.1Na
D.1 mol Si02晶体中含有2Na个Si一O键
6. 下列化学式既能表示物质的组成,又能表示物质分子式的是
A. NH4NO3 B. SiO2 C. C6H5NO2 D. Cu
7.在一密闭容器中,可逆反应aA(g)+b B(g)![]() cC(g)达平衡后,测得此时C的浓度为0.6 mol·L-1。若保持温度不变,将容器的容积压缩为原来的2/3,当重新达平衡后,C的浓度是0.8
mol·L-1。下列说法正确的是
cC(g)达平衡后,测得此时C的浓度为0.6 mol·L-1。若保持温度不变,将容器的容积压缩为原来的2/3,当重新达平衡后,C的浓度是0.8
mol·L-1。下列说法正确的是
A.物质A的转化率降低了 B.平衡向正反应方向移动
C.物质C的质量分数增加了 D.a+b>c
8.下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+,Cl—,Na+,H2PO4—,PO43—,SO42—
②使pH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—
③水电离的H+浓度c (H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—
⑤使甲基橙变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
9.下列叙述正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.现已发现的零族元素的单质在常温常压下都是气体
C.ⅥA族元素的原子,其半径越大,越容易得到电子
D.所有的主族元素的简单离子的化合价与其族序数相等
10.下列离子方程式书写正确的是
A.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-=AlO2-+2H2O
B.NaHCO3溶液水解:HCO3-+H2O=H2CO3+OH-
C.浓氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
D.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
11.将SO2通入CuSO4和NaCl的浓溶液中会析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.氧化剂 B.还原剂 C.酸 D .催化剂
12.常温下,Va L pH=2的盐酸与Vb L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是
A、Va 一定等于 Vb
B、Va 大于或等于 Vb
C、混合溶液中离子浓度一定满足: c(Cl-) > c(NH4+)> c(H+)> c(OH-)
D、混合溶液中离子浓度一定满足: c(NH4+) + c(H+) = c(Cl-)+ c(OH-)
13.将含有O2和CH4的混合气体置于盛有23.4 g Na2O2的密闭容器中,电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体产生。下列叙述正确的是
A、原混合气体中O2和CH4的体积比为2﹕1
B、残留物只有Na2CO3
C、原混合气体中O2与CH4的物质的量之比为1﹕2
D、残留物只有Na2CO3和NaHCO3
![]()
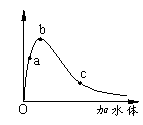 14.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法不正确的是
14.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法不正确的是
A.a、b、c三点溶液的pH:c>a>b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,
消耗氢氧化钠溶液体积:c<a<b
15.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
16.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将13.8g样品加入足量水中,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质的正确判断是
A、肯定没有KNO3 B、肯定有KNO3,可能还有Na2CO3
C、肯定没有Ba(NO3)2,可能有KNO3 D、肯定没有Na2CO3和Ba(NO3)2
17.铁酸钠(Na2FeO4)是一种新型的净水剂,制取铁酸钠的离子反应为:
Fe2O3 +NO3- +OH — → FeO42—+NO2— +H2O (未配平)
关于该反应的叙述错误的是
A、生成1mol FeO42—时,电子转移数为3mol
B、该反应中铁元素被氧化
C、该反应配平的离子方程式中H2O的系数为2
D、该反应中氧化产物与还原产物的物质的量的比为3∶1
郑州四中高三年级第四次月考化学试题
选择题答案栏
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
第II卷(非选择题 49分)
二、填空题(本题包括5个小题,共49分)
18.(8分)
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3—+4H++3e—→NO↑+2H2O,KMnO4、Na2CO3、Cu2O、Fe(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:
(2)反应中硝酸体现了 、 性质
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
19.(8分)某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发同耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1 535 |
| 沸点(℃0 | 2 467 | 2 750 |
(1) 某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理? - (填“合理”或“不合理”)。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含物中含有金属铝。
请填写下列表格:
| 所用试剂 | |
| 实验操作及现象 | |
| 有关反应的化学方程式 |
20.(10分)由短周期元素构成的常见离子,它们组成A、B、C、D四种物质,分别溶于水。已知:
①A、C的焰色反应呈黄色
②取A、B溶液,分别加入BaCl2溶液,均生成白色沉淀,再加入稀HNO3,A中沉淀溶解,并产生能使澄清石灰水变浑浊的无色、无臭气体,而B中无变化。
③在D的稀溶液中加入AgNO3溶液和稀HNO3,有白色沉淀生成。
④在D溶液中滴加C溶液,生成白色沉淀,继续滴入C,白色沉淀消失。
⑤A、B、C溶液的物质的量浓度相等,当A、B溶液以体积比1∶2混合时,生成无色气体;B、C溶液以体积比1∶2混合时,也生成无色气体,此气体能使湿润的红色石蕊试纸变蓝色;如果均以体积比1∶1混合,两者都不生成气体。
写出化学式:
A____________,B____________,C____________,D____________。
写出D溶液中不断滴入C溶液的离子方程式:________________________________________
.
|
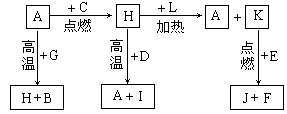 21.(12分)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
21.(12分)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式
。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 。
22.(11分)实验室可通过多条途径得到氮气,常见的三种方法是:
 方法一,将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜。
方法一,将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二,将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三,将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
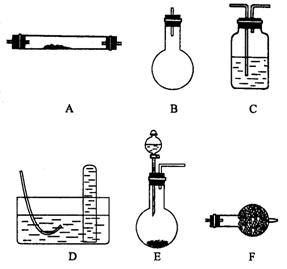
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未列出):请回答下列问题:
(1)工业上合成氨的化学方程式为 。
(2)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)________ 作发生装置,该反应的化学方程式_________ ________ 在实验中生石灰的作用是 。要制取并收集纯净的氮气(可含有少量的水),还使用上述仪器中的(填仪器的编号,并按气流方向从左向右列出)____________ 。
(3)写出方法三制氮气的反应原理:(用化学方程式表示)
,在制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于_____ _ _ 。
高三年级第四次月考化学试题
参考答案:
一.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| C | A | D | B | C | C | A | C | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| C | B | D | C | D | D | B | D |
二.
18.(8分)
(1)4HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O
(2)酸性 氧化性
(3)0.6mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
19.(8分)(1)合理(1分)
(2)用磁铁吸引,若能吸附,说明有铁生成(2分,只回答用磁铁吸引,给1分;其它答案合理且完全正确给1分)
(3)NaOH溶液(1分) 取少量样品放入试管,加入NaOH溶液,(1分)若有气泡产生,说明该熔融物中有铝(1分)
2Al+2NaOH+6H2O 2Na[Al(OH)3]+3H2↑
20.
答案:Na2CO3 NH4HSO4 NaOH AlCl3 Al3++3OH-====Al(OH)3↓ Al(OH)3+OH-====AlO2-+2H2O
解析:由实验①可知,A、C中都含有Na+;由实验②可知,A与氯化钡反应生成碳酸钡沉淀,从而得出A为碳酸钠;B与氯化钡生成的沉淀为硫酸钡,B中含有SO42-;由实验③可知,D中含有Cl-;由实验④可知C为NaOH,A为AlCl3;由实验⑤可知,B中含有NH4+,且含有H+,从而确定B为NH4HSO4。
21.(1)四;VIII (2)![]()
(3)3Fe3O4+8Al![]() 4Al2O3+9Fe
4Al2O3+9Fe
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
(6)镁带剧烈燃烧,放出耀眼的光,瓶壁出现白色固体和黑色颗粒;2Mg+CO2![]() 2MgO+C
2MgO+C
22.(1)N2+3H2![]() 2NH3↑
2NH3↑
(2)E CaO+NH3•H2O=NH3↑+Ca(OH)2 生石灰溶于水产生大量的热,并且电离产生OH- E→F→A→C→D
(3)NaNO2 + NH4Cl == N2 + NaCl + 2H2O Cu和CuO可以循环使用,避免因使用有毒的物质NaNO2而造成污染