高三年级化学上册联考试题
命题人:张厚平 校对人:陈大鹏
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分120分,考试时间100分钟。
第I卷(选择题,共50分)
可能用到的原子量:H-1 C-12 O-16 Na-23 Mg-24 S-32 Cu-64 Fe—56
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
1、近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在
47 0℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是:( )
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
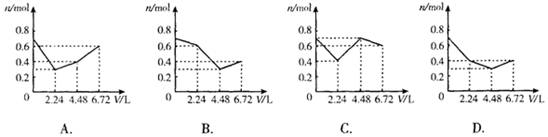
2、 往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解忽略不计) ( )
3、下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是 ( )
A.蔗糖 B.麦芽糖 C.丙酸丙酯 D.丙酸乙酯
4、市场上销售的“84”消毒液,其商品标识上有如下叙述①本品为无色液体;②使用时加水稀释;③可对餐具、衣物进行消毒,其有效成分可能是 ( )
A.Cl2 B.SO2 C.NaClO D.KMnO4
5、某溶液中含有HCO3—、SO32—、CO32—、CH3COO—等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度几乎保持不变的是(假定溶液体积无变化) ( )
A.HCO3— B.SO32— C.CO32— D.CH3COO
6、下列各项中指定的比值是2:1的是 ( )
A.Na2S溶液中c(Na+)与c(S2-)之比
B.Na2O2晶体中阳离子与阴离子的数目比
C.18O原子核内中子数与质子数之比
D.C2H4在氧气中充分燃烧生成的CO2和H2O的物质的量之比
二、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就0分。)
7、钡在氧气中燃烧时得到一种钡的氧化物晶体, 结构如下图所示, 有关说法正确的是( )
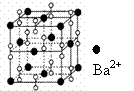 A.该晶体属于离子晶体
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
8、下列各组中的离子或分子相混合,肯定会有沉淀生成的是 ( )
A.A13+、Na+、SO42-、OH- B.Ag+、NH3·H2O、NO3-
C.Ba2+、H+、NO3-、PO43- D.Na+、A13+、C1-、SO32-
9、短周期元素A和B,其中:A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a—b),L层电子数是(a+b),则A、B两种元素形成化合物的化学式可能表示为( )
A.B3A2 B.BA2 C.A3B2 D.AB2
10、在101kPa和25℃时,有关反应的热化学方程式如下:
H2(g)+1/2O2(g)= H2O(g);△H1=-241.8kJ/mol
H2(g)+1/2O2(g)= H2O(l);△H2=―285.8kJ/mol
下列说法错误的是 ( )
A.H2在氧气中燃烧生成1molH2O(g)时放出241.8kJ的热量
B.H2的燃烧热为285.8kJ
C.O2前面的1/2表示参加反应的O2的物质的量
D.1mol液态水变成水蒸汽时吸收44kJ的热量
11、2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰 (化学式为COS) 的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是 ( )
A.1 mol硫化羰在氧气中完全燃烧时转移6mol电子
B.硫化羰可用作灭火剂
C.CO2和COS结构相似都是非极性分子
D.硫化羰熔点可能很高
12、制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油, ②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并密封冷却, ④加入少量铁屑, ⑤加入少量CCl4, ⑥向FeSO4溶液中滴入足量氨水, ⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。其中必须进行的操作及其正确顺序是 ( )
A.③②④①⑦ B.③②⑤⑥④ C. ③②④⑤⑦ D.②④①⑦⑤
13、某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
14、如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:
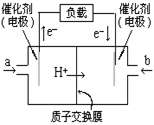 2CH3OH+3O2=2CO2+4H2O。
2CH3OH+3O2=2CO2+4H2O。
、下列说法中正确的是 ( )
A.右边的电极为电池的负极,b处通入的是空气
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH-
第II卷(非选择题,共70分)
三、(本题包括3小题,共26分)
15、(4分)下列关于实验的描述不正确的是 ( )
A、谜语:“我入水中较安全,水入我中真危险,我与水合多放热,实验牢记保平安。”这一实验操作是指稀释浓硫酸。
B、实验室常常采用蒸馏法分离酒精和苯酚(沸点1820C)的混合物。
C、在烧杯中加入水和苯(密度:0.88g/cm3)各50mL。将一小粒金属钠(密度:0.97g/cm3) 投入烧杯中,所观察到的现象是钠在苯与水的界面处反应并可能作上、下跳动,直至消失。
D、因为在金属活动性顺序表中Ag排在H的后面,所以在任何条件下都不可能实现2HCl+2Ag=2AgCl+H2↑反应。
E、由于CH3COOH是弱电解质,所以在实验室很难配置pH=1的CH3COOH溶液。
F、用碱式滴定管量取25.00mL溴水
16、(10分)(1)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):___________________________________________。
②容量瓶:________________________________________________________。
③滴定管:________________________________________________________。
④集气瓶(收集氯化氢):___________________________________________。
⑤托盘天平________________________________________________________。
17、(12分)为了测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取W g固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g
丙组:量取25.00mL上述溶液,用a
mol/L 的酸性KMnO4溶液进行滴定。(![]() ),消耗KMnO4溶液b mL。
),消耗KMnO4溶液b mL。
(1)配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和 、 。
(2)在丙组实验中滴定时是否需要选择指示剂? (填“需要”或“不需要”)。滴定终点的颜色变化是 。
(3)用丙组的实验数据,计算Na2SO3的纯度为 。
(4)实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低得多。试分析产生上述现象的原因
。
四、(本题包括2小题,共20分)
18、(10分)A、B、C、D为周期表中前三周期元素,A元素原子的次外层电子数是最外层电子数的二分之一,B的阴离子核外只有一个电子层、C单质在标准状况下密度是1.43g/L,D元素的焰色反应呈黄色。将以上四种元素组成的结晶盐3.4g加热反应至完全失去结晶水,其质量减少1.35g,所得无水盐中C元素的质量分数为39%,将该无水盐与适量盐酸作用得到一种弱酸,再将所得弱酸完全燃烧可得0.9g水和1.12L标准状况下的CO2,已知这种弱酸的一个分子中共有32个质子。试回答:
(1)A、B、C、D四种元素各是什么元素:A B C D
(填元素符号)
(2)求结晶盐化学式:
19、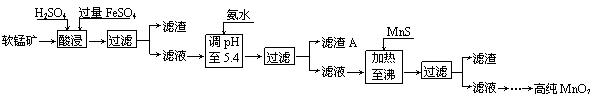
(10分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写两种)。
五、(本题包括1小题,共16分)
20、下图中A、B、C、D、E、F、G均为有机化合物。注:A的分子式应为C13H1803
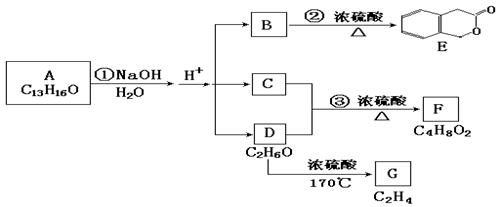
⑴ D的化学名称是 。
⑵ 反应③的化学方程式是 。
⑶ B的分子式是 ,
A的结构简式是 。反应①的反应类型是 。
⑷ 符合下列三个条件的B的同分异构体的数目有 个。
①含有邻二取代苯环结构;②与B具有相同的官能团;③不可与FeCl3溶液发生显色反应写出其中任意一个同分异构体的结构简式 。
⑸ G是重要的工业原料,用化学方程式表示G的一种重要工业用途
。
六、(本题包括1小题,共8分)
21、(8分)铁粉和铜粉的均匀混合物,平均分成三等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编号 | ① | ② | ③ |
| 稀硝酸体积/mL | 100 | 200 | 300 |
| 剩余金属/g | 30.4 | 22 | 12.8 |
| NO体积/mL | 2240 | 4480 | 6720 |
由上述数据推测:
(1)硝酸的物质的量浓度。
(2)③比②多溶解部分的金属,其成分是什么?其相应的质量又为多少克?
(3)向反应后的①中加入足量的该稀硝酸时,又生成气体的体积在标准状况下为多少L?
、
高三年级联考化学试题答题纸
一、二、选择题(本题包括14小题,共50分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
三、(本题包括3小题,共26分)
15. (4分)
16.(10分)(1) (2)
(3)
(4) (5)
17.(12分)(1) 、
(2) ,
(3) ; (4)
四、(本题包括2小题,共20分)
18.(10分)(1)A B C D 。(2) 。
19.(10分)(1)
(2) (3)
(4) (5)
五、(本题包括1小题,共16分)
20.(8分)(1) (2) ;
(3)
(4)
(5)
六、(本题包括1小题,共8分)
21.
|
高三年级联考化学试题参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 |
| B | D | A | C | D | B |
二、选择题
| 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| AD | D | B | B | A | A | C | BC |
三、(本题包括2小题,除15题外,其余每空2分,共26分)
15. (4分) D、F
16(10分)(1) 把试纸用蒸馏水湿润 (2) 检查容量瓶是否漏水
(3) 用待装液润洗滴定管2~3次(也可以写:检查滴定管是否漏水)
(4) 干燥集气瓶 (5) 调节零点
17.(12分)(1) 托盘天平 ; 250mL的容量瓶
(2) 不需要 , 紫色不褪色。
(3) ![]() 或 63ab/20w
或 63ab/20w
(4) 盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,遇Ba2+结合生成BaSO4沉淀。
四、(本题包括2小题,每空2分,共20分)
18、(10分)①A为 C B为 H C为 O D为 Na ② CH3COONa·3H2O
19、(10分)(1)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O (2)Fe(OH)3 Al(OH)3
(3)Cu2+
Zn2+ (4)MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-)
(5)锌、二氧化锰
五、(本题包括1小题,每空2分,共16分))
20、(1)乙醇 (2)CH3COOH+CH3CH2OH →CH3COOCH2CH3+H2O
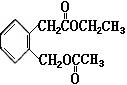 |
(3)C9 H10 O3 水解反应
(4)3
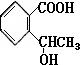
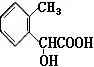

(填写其中一个结构简式即可)
(5)nCH2=CH2![]()
![]() CH2-CH2
CH2-CH2![]() n
;
n
;
或CH2=CH2+ H2O![]() CH3CH2OH(写出任一个合理的反应式即可)
CH3CH2OH(写出任一个合理的反应式即可)
六、(本题包括1小题,共8分)
21.(1)(2分)3M + 8HNO3 = 3M(NO3)2 + 2NO‹+ 4H2O
8 2
0.4 2240/22400=0.1
CHNO3=4mol/L
(2)(3分)由表中数据可知,剩余金属①②相差8.4g ,②③ 相差9.2g ,所以③中肯定溶解了铁和铜,
设③中溶解的铁的物质的量为x ,溶解的铜的物质的量为y
![]()
![]() x + y =2240/22400 ×1.5
x=0.05 mol
x + y =2240/22400 ×1.5
x=0.05 mol
56x + 64y =22-12.8 y=0.1 mol
mFe=0.05×56=2.8g
mCu=0.1×64=6.4g
(3)(3分)![]() Cu的总质量为=12.8+6.4=19.2g 0.30
mol
Cu的总质量为=12.8+6.4=19.2g 0.30
mol
Fe的总质量为=30.4+8.4-19.2=19.6g 0.35 mol
Fe――-NO 3Cu―――― 2 NO
气体的总物质的量为0.35+0.30×2/3=0.55 mol
所以又生成气体的物质的量为0.55-0.10=0.45 mol,标况下体积为0.45×22.4=10.08 L