高三年级化学第一次模拟考试试题
可能用到的相对原子质量: H:1 C:12 O:16 S:32 Na:23 Cl:35.5 Ba: 137
第Ⅰ卷(选择题共57分)
一、选择题(本题包括19小题;每小题3分,共57分,每小题只有一个选项符合题意)
1.用NA表示阿伏加德罗常数,下列说法错误的是
A. 乙醇的摩尔质量(g / mol)与NA个乙醇分子的质量(g)在数值上相等
B. 1mol Mg作为还原剂可提供的电子数为2NA
C. 常温常压下,28 gCO中所含碳原子数为0.5NA
D. 0.5 L、0.2 mol / L的Fe2(SO4)3溶液中含SO42-个数为0.3 NA
2.与Ne的核外电子排布相同的阴离子跟与Ar的核外电子排布相同的阳离子所形成的化合物是
A.MgBr2 B.Na2S C.CCl4 D.KF
3.A、B均为原子序数1~20的元素,已知A的原子序数为n,A2+比B2-少8个电子,则B的原子序数是
A.n+4 B.n+6 C.n+8 D.n+10
4.过氧化氢(H2O2),既有氧化性又有还原性,H2O2和硫酸酸化的KMnO4反应如下:2KMnO4+5H2O2+3H2SO4===2MnSO4+K2SO4+5O2↑+8H2O,如果H2O2中的氧原子是示踪原子(O),当反应完成后,含有示踪原子的物质是
A.O2 B.H2O C.MnSO4 D.K2SO4
5.某Na2SO3样品已部分氧化为Na2SO4,经测定该混合物中含S 25%,则混合物中Na2SO3与Na2SO4的物质的量之比为
A.7 :6 B.6 :7 C.1 :7 D.7 :1
![]()
![]() 6.下列各项中表达正确的是
6.下列各项中表达正确的是
 A.NH3分子的电子式:
B.CH4分子的比例模型
A.NH3分子的电子式:
B.CH4分子的比例模型
C.O原子的结构示意图: D.N2的结构式: N≡N
7.反应4NH3+5O2![]() 4NO+6H2O在5升的密闭容器中进行,半分钟后,NO的物质的量增加了0.3摩尔,则此反应的平均速度
4NO+6H2O在5升的密闭容器中进行,半分钟后,NO的物质的量增加了0.3摩尔,则此反应的平均速度![]() x(表示反应物的消耗速度或生成物的生成速度)为
x(表示反应物的消耗速度或生成物的生成速度)为
A. ![]() O2=0.01 mol·(L·min)
━1 B.
O2=0.01 mol·(L·min)
━1 B.![]() NO=0.008 mol·(L·min)
━1
NO=0.008 mol·(L·min)
━1
C.![]() H2O=0.003 mol·(L·min)
━1 D.
H2O=0.003 mol·(L·min)
━1 D. ![]() NH3=0.004 mol·(L·min) ━1
NH3=0.004 mol·(L·min) ━1
8.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成的化学式最可能表示为
A.B3A2 B.BA2 C.A3B2 D.AB2
9、下列离子方程式中正确的是
A.单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+ CO32-+2H2O
C.过氧化钠与水反应:2Na2O2+2H2O = 4Na++4OH-+O2↑
D.CH3COOH溶液与NaOH溶液反应: H++ OH-=H2O
10. 2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2 + 7O2 ![]() 2MoO3 + 4SO2;②MoO3 + 2NH3·H2O = (NH4)2MoO4
+ H2O; ③(NH4)2MoO4
+ 2HCl = H2MoO4↓+ 2NH4Cl; ④H2MoO4
2MoO3 + 4SO2;②MoO3 + 2NH3·H2O = (NH4)2MoO4
+ H2O; ③(NH4)2MoO4
+ 2HCl = H2MoO4↓+ 2NH4Cl; ④H2MoO4 ![]() MoO3 + H2O;⑤ 用还原剂将MoO3还原成金属钼。则下列说法正确的是
MoO3 + H2O;⑤ 用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
11.下列各组离子在溶液中可以大量共存,且加入氨水后也不产生沉淀的是
A.H+ I- Cl- NO3- B.K+ AlO2- NO3- OH-
C.H+ NH4+ Al3+ SO42- D.H+ Cl- CH3COO- NO3-
12.韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。下列关于“暖冰”的说法正确的是
A.水分子中的3个原子位于同一条直线上
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.水分子中各原子均满足8电子稳定结构
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
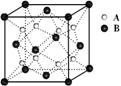 13.某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
13.某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
A.BA2 B.B2A
C.B7A4 D.B4A7
14.某共价化合物分子中含有C、N、H三种元素,若以x、y分别表示C和N的原子数目(分子结构只含一个N原子),则分子中氢原子数最多是
A.2x+2 B.2x+2y+2 C.2x+y+2 D.2x+2y+3
15、短周期非金属元素X和Y能形成XY2型化合物。下列有关XY2的判断不正确的是
A.XY2不一定是分子晶体 B.XY2的电子式是:∶Y∶∶X∶∶Y∶
C.XY2水溶液不可能呈碱性 D. X、Y可能是同主族的元素
16.使5.6L CO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况),这4.48L气体的质量为
A.8.8g B.6.4g C.8.2g D.6.2g
17.已知
(l)![]() =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·![]()
(2)![]() =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·![]()
(3)![]() =H2O(l) △H3=c
kJ·
=H2O(l) △H3=c
kJ·![]()
(4)![]() =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·![]()
下列关系式中正确的是
A. a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
18、酸根RO![]() 所含电子数比硝酸根NO
所含电子数比硝酸根NO![]() 的电子数多8,则下列说法正确的是
的电子数多8,则下列说法正确的是
A.R和N为同族元素
B. RO![]() 中R的化合价与NO
中R的化合价与NO![]() 中的N的化合价相等
中的N的化合价相等
C. RO![]() 即能被氧化又能被还原
即能被氧化又能被还原
D. R原子的电子层数比N的电子层数多1
19、.“钴酞菁”分子(直径约为1.34×10—9m)结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
A.“钴酞菁”分子在水中所形成的分散系属浊液
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C.在分散系中,“钴酞菁”分子的直径比Na+的直径小
D.“钴酞菁”分子在水中形成的分散系能产生丁达尔现象
二、填空题:
20.(8分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH![]() 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO![]() 、NO
、NO![]() 、OH-、CO
、OH-、CO![]() 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是 ,判断理由是
。
(2)写出其余几种物质的化学式:A B C
(3)写出实验②中有关反应的离子方程式
。
21、(17分)A、B、C、D是原子序数依次增大的短周期元素,且互不同族,其中A、B为金属;A原子的最外层电子数与次外层电子数相等;A与D、B与C这两对原子的最外层电子数之和均为9。单质B与D都可与浓的NaOH溶液反应。回答下列问题:
⑴A元素在周期表中的位置是
⑵D的氢化物的电子式是 ,它形成晶体时属于 晶体。
⑶B与浓NaOH溶液反应的化学方程式为
⑷B、C、D、E四元素的单质及化合物有下图的转化关系,已知J溶液的焰色为黄色。
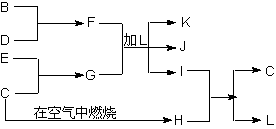
①写出化学式I ; L
② F、G、L发生反应的离子方程式为
③ 若1gC在空气中燃烧生成H时放出aKJ的热量,表示此物质燃烧热的热化学方程式为
22.(14分)
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②X分别与Y、Z、W可组成化学式为YX3、X2Z和X2W三种共价化合物
请填空:
(1)X、Y、Z原子最外层电子数之和是 ;
(2)X2W的电子式是 ,YX3、X2Z和X2W形成的晶体类型都属于
;
(3)X、Y和Z组成的一种化合物是强酸。写出该酸的稀溶液与铜反应的离子方程式:
X、Y和Z组成的另一种化合物是离子化合物,该离子化合物在210℃分解生成一种只含Y、Z的气体和一种只含X、Z的液体(在常温、常压下)。已知40g该离子化合物完全分解可生成11.2L的气体(标准状况下),该气体的化学式为:
;
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5:1:3:1;该化合物具有还原性。
①写出该化合物与过量稀NaOH溶液反应的离子方程式:
②请设计实验证明该化合具有还原性:
。
23.(5分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答(1)~(3)题。
⑴下列氢化物中最稳定的是 ;
A.HCI B.HBr C.HI D.HF
⑵X2+H2=2HX(X代表Cl、Br、I)的反应是 (填“吸热”或“放热”)反应;
⑶相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 ;
⑷写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:
。
24.(9分)在标准状况下,取甲、乙、丙各30mL相同浓度的盐酸然后分别慢慢加入组成相同的镁铝合金粉末,得到下表中有关数据(本题中假设反应前后溶液体积不发生变化),请回答:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”、“足量、不足量”,下同) ;乙组实验中盐酸 。
(2)盐酸的物质的量浓度为 。
(3)合金中镁铝的物质的量之比为 。
(4)丙实验之后,向容器中加入一定量的1.00mol/LNaOH溶液,能使合金中的铝粉恰好溶解,再过滤出不溶性固体,则所得滤液中各溶质的物质的量浓度为 。
答案
1-----5 C D A A D 6------10 D C B C D 11-----15 B D A C B 16---19 C C D D
20.(9分)(1)(NH4)2CO3(1分);D和A、B都能生成气体,而题给离子中只有H-与CO![]() 、OH-与NH
、OH-与NH![]() 能反应生成气体,故D只能为(NH4)2CO3(2分)
能反应生成气体,故D只能为(NH4)2CO3(2分)
(2)A.H2SO4 B.NaOH C.Ba(NO3)2 (每空1分,共3分)
(3)NH![]() +OH-=NH3↑+H2O NH3+H+=NH
+OH-=NH3↑+H2O NH3+H+=NH![]() (3分,错一个扣2分,扣完为止)
(3分,错一个扣2分,扣完为止)
![]() 21. (17分)
21. (17分)
⑴第二周期第ⅡA族(2分) ⑵ (2分); 分子(2分)
⑶2Al+2NaOH+2H2O=2NaAlO2+3H2↑(3分) (4)①H2S H2O(各1分)
②2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑(3分)
③S(s)+O2(g)=SO2(g) ;ΔH=-32aKJ/mol(3分)
|
(2)H : S : H(2分) 分子晶体 …………(1分)
(3)3Cu+2NO![]() +8H+
+8H+ 3Cu2++2NO↑+4H2O;(2分)N2O …………(3分)
(4)①NH![]() +HSO
+HSO![]() +2OH—
+2OH— NH3·H2O+SO![]() +H2O …………(2分)
+H2O …………(2分)
②取少量该化合物溶解,加入KMmO4酸性溶液,紫色褪色,证明该化合物具有还原性。(其他合理答案均给分)
23
(1).D
(2)放热
(3)氯气
(4)Cl2(g)+H2(g)=== 2HCl(g) △H=-185kj/mol
24.(19分)
(1)过量(1分),不足量(2分)
(2)1.00mol/L.................. (4分)
(3)1︰1.................... (4分)
(4)c(NaCl)=(3.00×10—2mol)/(6.9×10—2L)=0.435mol/L.........(4分)
c(NaAlO2)=(9.00×10—3moL)/(6.9×10—2L)=0.13mol/L.......... (4分)