高三理综(化学)重组试题卷Ⅰ 4.8
1.(东北三校2008年高三第一次联考)向100mL pH=0的硫酸和硝酸的混合液中投入3.2g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况)。则反应前的混合溶液中硝酸的物质的量浓度为
A.0.2mol/L B.0.25mol/L C.0.4mol/L D.0.8mol/L
2.(东北三校2008年高三第一次联考)下列各组离子在指定条件下,一定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32—、NO3—
B.c(H+)=0.1 mol/L的溶液中:Cu2+、Al3+、SO42-、NO3—
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D.水电离出的c(H+)=1×10—12 mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
3.(东北三校2008年高三第一次联考)某元素X核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关X的说法中,不正确的是
A.X能形成化学式为X(OH)3的碱
B.X能形成化学式为NaXO3的含氧酸钠盐
C.X原子的最外层电子数和核电荷数不可能为偶数
D.X能与某些金属元素或非金属元素形成化合物
4.(甘谷县2008年高三级第二次检测)下列各物质中存在极性键和非极性键,且属于离子晶体的是
A.醋酸钠 B.碳化钙 C.氯化铵 D.过氧化氢
5.(甘谷县2008年高三级第二次检测)下列离子方程式正确的是
A.纯碱溶液显碱性的化学原理:CO32-+2H2O ![]() H2CO3+2OH-
H2CO3+2OH-
B.Na与冷水反应: Na+2H2O=Na++2OH-+H2↑
C.澄清石灰水中通入少量CO2气体:Ca2++2OH-+CO2=CaCO3↓+H2O
D.Fe粉与足量稀硝酸反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4 H2O
6.(甘谷县2008年高三级第二次检测)下列实验操作正确的是
A. 除去CO2中的少量SO2:通过盛有足量饱和Na2CO3溶液的洗气瓶
B.将浓硝酸与浓硫酸混合时,将浓硝酸缓慢加入到盛有浓硫酸的烧杯中,并不断搅拌
C.在洁净的试管里加入1mL 2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀溶解为止来配制银氨溶液
D.酸碱中和滴定时,装待测液的锥形瓶先用待测液润洗
7.(甘谷县2008年高三级第二次检测)某温度下,密闭容器中发生反应aX(g)![]() bY(g)+cZ(s),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度均是原来的1.8倍.则下列叙述正确的是
bY(g)+cZ(s),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度均是原来的1.8倍.则下列叙述正确的是
A.可逆反应的化学方程式的系数:a>b+c
B.压缩容器的容积时,![]() 增大,
增大,![]() 减小
减小
C. 达到新平衡时,混合物中Z的质量分数增大
D.达到新平衡时,物质X的转化率减小
8.(甘谷县2008年高三级第二次检测)将0.20mol·L-1的CH3COOH溶液和0.10mol·L-1的NaOH溶液等体积混合,充分反应后,下列有关该溶液中各粒子浓度的关系不正确的是
A. c(Na+) =c(CH3COOH)+c(CH3COO-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COOH)+c(CH3COO-)=0.10mol·L-1
D. c(CH3COO-)>c(Na+)>c(H+) >c(OH-)
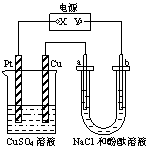 9.(2008年黄冈中学等八校第一次联考)设NA为阿伏加德罗常数,下列说法不正确的是
9.(2008年黄冈中学等八校第一次联考)设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下22.4LCl2和H2混合气体原子数为2NA
B.1molNa2O2和足量的水完全反应,转移的电子数为NA
C.1mol金刚石中含共价键数目为4NA
D.电解食盐水若产生2g氢气,则转移的电子数目为2NA
10.(2008年黄冈中学等八校第一次联考)如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是
A.x是正极,y是负极,CuSO4溶液的pH逐渐减小
B.x是正极,y是负极,CuSO4溶液的pH保持不变
C.x是负极,y是正极,CuSO4溶液的pH 逐渐减小
D.x是负极,y是正极,CuSO4溶液的pH保持不变
11.(2008年黄冈中学等八校第一次联考)A、B、C、D为原子序数依次增大的四种短周期元素,A、D同主族,B、C同周期。它们中的两种元素可形成多种原子个数比为1﹕1的化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 元素种类 | A、B | A、C | A、D | C、D |
通常情况下,甲为气体,密度比空气略小;乙为液体;丙和丁为固体且均为离子化合物。请填写下列空白:
(1)D元素的原子结构示意图为 ,乙的电子式为 ,丁中阴离子与阳离子的个数比为 ;
(2)已知在标准状况下,5.6升的甲完全燃烧放出的热量为325 KJ,试写出表示甲的燃烧热的热化学方程式: ;
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式 ;
(4)已知丙的晶体结构与NaCl相似,则该晶体中与D离子距离最近的D离子有 个;有资料显示,丙是一种危险物质,其反应活性很高,在潮湿的空气中能自燃。试解释原因(用化学方程式表示)
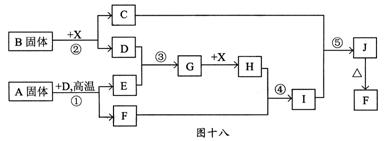 12.(河南驻马店2008高三第三次模拟)根据下图十八所示关系填空,已知所有字母表示的是纯净物或水溶液,反应①、③是工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,H与E相对分子质量之间的关系为Mr(H)—Mr(E)=34,又知C焰色反应火焰呈黄色。
12.(河南驻马店2008高三第三次模拟)根据下图十八所示关系填空,已知所有字母表示的是纯净物或水溶液,反应①、③是工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,H与E相对分子质量之间的关系为Mr(H)—Mr(E)=34,又知C焰色反应火焰呈黄色。
(1)B固体中所包含的化学键有______________________;
(2)反应①的化学方程式为__________;反应⑤的离子方程式为__________________;
(3)工业上反应③的条件为_______________________________________;
(4)在工业上G是如何转化为H的?
(请用文字叙述)。
13.(2008年黄冈中学等八校联考)某校化学课外活动小组利用下图装置制备氯化铝固体,并用该固体配制氯化铝溶液。装置中a为长玻璃导管,b为玻璃活塞。实验中可供选用的试剂有:①二氧化锰固体;②铝粉;③氯化钠固体;④浓硫酸;⑤浓盐酸;⑥蒸馏水;⑦碱石灰。资料表明:氯化铝受热至180℃时即升华,在潮湿的空气中易水解。
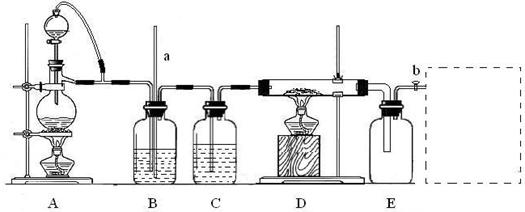
回答下列问题:
(1)检查该装置气密性的方法是___________________________________。
(2)A中气体制备的离子方程式是_________________________。如果可供选择的试剂中无浓盐酸,该小组同学用已供试剂也完成了该实验,则A装置中选用的试剂是____(填序号)。
(3)实验中B装置的作用是_________________________________。
(4)D、E间导管短且粗,原因是___________________________。
(5)用实验制得的氯化铝固体配制溶液的方法是_______________________。
(6)请在E后的虚线框中补充完善该装置。该装置中应盛放的试剂是______(从题中可供试剂中选择,填序号)。
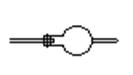
14.(2008年天津市十二区县)茚是碳氢化合物,其结构为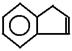 ,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系:
,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系:
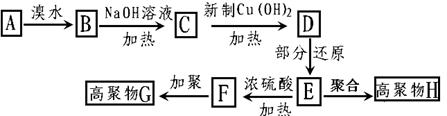
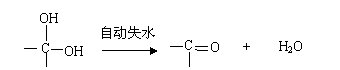
已知:①一个碳原子上同时连2个羟基不稳定,会失水形成羰基;
② B、C、D、E的分子结构中均有一个苯环。
根据转化关系和已知条件,试回答:
(1)A中所含官能团的名称 B的结构简式
C的结构简式
(2)A→B、C→D的反应类型分别是__________反应、___________反应。
(3)①写出C→D的化学反应方程式:
②写出E生成高聚物H的化学方程式__________________________________
③写出F与乙醇反应的化学方程式
(4)①A分子有多种同分异构体,试写出与A同类别且只有一个侧链的同分异构体的结构简
式
②写出符合下列3个条件的E的所有同分异构体的结构简式:
a.遇氯化铁显紫色 b.含有邻二取代苯环结构
c.能发生水解反应但不能发生银镜反应。
高三理综(化学)重组卷Ⅰ 4.8
1.A 2.B 3.A 4.A 5.C 6.C 7.D 8.A 9.C 10.A
11.(15分)(1)
(1分) ![]() 1︰2
1︰2
(2)C2H2(g)
+ ![]() O2(g) = 2CO2(g) + H2O(l); △H = -1300kJ/mol
O2(g) = 2CO2(g) + H2O(l); △H = -1300kJ/mol
(3)H2O2
![]() H+ + HO2-(1分); HO2-
H+ + HO2-(1分); HO2-![]() H+ + O22-
H+ + O22-
(4)12 ;NaH + H2O = NaOH + H2,2H2 + O2 = 2H2O[或2NaH + O2 燃烧 2NaOH]
12.(1)离子键、共价键
(2)4FeS2 +11O2 ![]() 2Fe2O3 + 8SO2 (不注明高温扣分);Fe3+ +3OH- =
Fe(OH)3↓
2Fe2O3 + 8SO2 (不注明高温扣分);Fe3+ +3OH- =
Fe(OH)3↓
(3)400℃~500℃,催化剂
(4)在吸收塔用98.3﹪的浓硫酸吸收SO3
13.(1)在B中加入蒸馏水至淹没玻璃导管a的下端,关闭活塞b,微热A装置中的烧瓶,若导管a中的液面上升一定的高度,则气密性良好。(其它合理方案参照得分)
(2)4H+ + 2Cl- + MnO2 △ Mn2+ + Cl2↑+ 2H2O; ①、③、④
(3)①洗除Cl2中的HCl气体;②安全瓶
(4)防止AlCl3凝结堵塞导管。
 (5)将固体AlCl3溶于较浓的盐酸,然后加入蒸馏水稀释至所需浓度。
(5)将固体AlCl3溶于较浓的盐酸,然后加入蒸馏水稀释至所需浓度。
(6) (或合理答案)) ⑦
14.碳碳三键 ![]()
(2)加成、氧化
(3) ①  +2Cu(OH)2
+2Cu(OH)2![]()
![]() +Cu2O↓+2H2O
+Cu2O↓+2H2O
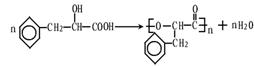 ②
②
③
![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O
+H2O
![]()
![]()
(4) ① ②