高三理综化学重组试题卷Ⅱ 4.9
1.(广西百色高中三校2008年联考)下列离子方程式正确的是
A.苯酚钠溶液中通入少量二氧化碳:2C6H5O- + CO2 + H2O = 2C6H5OH + CO32-
B.碳酸氢钙溶液中加入少量烧碱:Ca2+ + 2HCO3- + 2OH- = CaCO3↓ + CO32- +
H2O
C.新制氯水中滴入少量溴化亚铁溶液:2Fe2+
+ 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
D.锌与1mol/LHNO3溶液反应:Zn + 2H+ = 2Zn2+ + H2↑
2.(湖北省鄂南高中2008年训练题)江苏一男子感染禽流感,于2007年12月2日死亡。而从中药材提取的金丝桃素对人工感染的H5N1 亚型禽流感家禽活体具有良好的治愈率。已知金丝桃素的结构简式如右图所示。下列有关说法正确的是
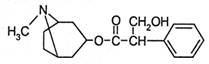 A.金丝桃素的分子式为C17H22O3N
A.金丝桃素的分子式为C17H22O3N
B.金丝桃素不能与浓硫酸和浓硝酸的混合液反应
C.金丝桃素能在NaOH溶液中加热反应得到两种芳香族化合物
D.金丝桃素在一定条件下能发生加成、酯化、消去和氧化反应
3.(石家庄市2008年质量检测) 根据相关事实,所得结论正确的是
A.HCl的相对分子质量比HF大,故HCl的沸点比HF高
B.苯不能使酸性KMnO4溶液褪色,故苯没有还原性
C.CO2通入苯酚钠溶液中产生浑浊,故酸性H2CO3>C6H5OH
D.常温下白磷可自燃而氮气须在放电时才能与氧气反应,故非金属性P>N
4.(石家庄市2008年质量检测) 如图所示,甲容器容积固定不变,乙容器有可移动活塞。甲中充入2 mol SO2和1mol O2,乙中充入2 mol SO3和1mol He,在恒定温度和催化的相同剂条件下,达到如下平衡:2SO3(g)
![]() 2SO2(g)+ O2
(g)。下列有关说法正确的是
2SO2(g)+ O2
(g)。下列有关说法正确的是
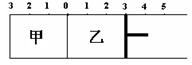 A.若活塞固定在3处不动,达平衡时两容器中的压强相等
A.若活塞固定在3处不动,达平衡时两容器中的压强相等
B.若活塞固定在3处不动,达平衡时两容器中SO3的浓度相等
C.若活塞固定在4处不动,达平衡时两容器中SO3的物质的量
分数相等
D.若活塞固定在5处不动,达平衡时乙容器中SO2的物质的量较小
5.(河南省驻马店2008届第三次模拟) 下列有关化学实验的操作或者说法中,正确的是
A.用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低
B.配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉
C.将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷
D.将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖
6.(河南省驻马店2008届第三次模拟) 已知乙烷的燃烧热为1190kJ/mol,下列表述正确的A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l);![]() =-1190kJ/mol
=-1190kJ/mol
B.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(g);![]() =-1190kJ/mol
=-1190kJ/mol
C.298k、101kPa时,30g乙烷完全燃烧生成CO2气体和液态水,放出1190kJ热量;
D.该反应中,反应物所具有的总能量小于生成物所具有的总能量。
7.(河南省驻马店2008届第三次模拟) 反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2 (1)
2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2 (2)
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2>![]() >
>![]() >I2
>I2
D.反应(1)、(2)中生成等量的I2时转移电子数比为1∶5
8.(河南省驻马店2008届第三次模拟) 关于下列各装置图的叙述中,不正确的是
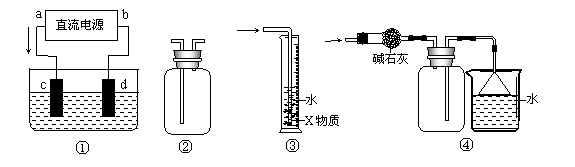 |
A.装置①中,c为阴极,d为阳极
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
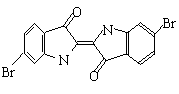 9.(河南省驻马店2008届第三次模拟) 泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍。当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如下图所示的含溴有机化合物,下列说法不正确的是
9.(河南省驻马店2008届第三次模拟) 泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍。当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如下图所示的含溴有机化合物,下列说法不正确的是
A.泰雅紫分子的分子式为:C16H8N2Br2O2
B.1mol泰雅紫与H2加成最多需9molH2
C.泰雅紫属于烃的衍生物
D.检验泰雅紫中溴元素可直接加入硝酸银溶液,观察是否有浅黄色沉淀生成
10.(北京市崇文区2008统一练习)(1)下列曲线分别表示元素的某种性质与该电荷数的关系(Z为该电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
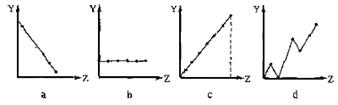
①ⅡA族元素的在外层电子数 。
②第3周期元素的最高化合价 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,
据此回答:
①N的最高价氧化物的水化物的化学式是 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度最小,则化合物A中的化学键类型为 ,若B为常见家用消毒剂的主要成分,则B的化学式是 。
③Z与M形成的稳定固体化合物的电子式为 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成一种可观察到的实验现象是 。
11.(湖北省鄂南高中2008训练题3)某同学在探究常见物质转化时,发现部分物质间存在如图所示三角转化关系。
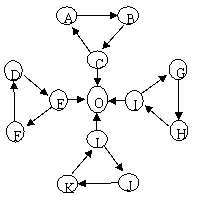 已知:①图中每个小三角中的三种物质至少含有一种相同元素。
已知:①图中每个小三角中的三种物质至少含有一种相同元素。
②D、J为固体单质,O为气体单质,其余物质为常见化合物。
③A能使品红溶液褪色,也能使澄清石灰水变浑浊;E为淡黄色
化合物,与C反应生成O,与L反应也能生成O;K、L
所含元素完全相同。
④I为两性氧化物,电解可生成O,G与L反应生成
难溶物H,H具有较强的吸附性。
试回答下列问题:
⑴ I的化学式:
⑵ 写出L-J反应的化学方程式
⑶ 常温下,测得一定浓度G溶液的pH=10,试用离子方程式表示其原因:
⑷写出E与C反应的离子方程式:
12.Ⅰ、(编者原创)下列叙述正确的是
A. NO和NO2是大气的污染物,空气中的NO和NO2污染物主要来自石油产品和煤燃烧产物、汽车尾气以及硝酸工厂废气中等,NO与NO2等氮的氧化物可以计入空气污染指数
B. 硝酸是一种强氧化剂,可以与所有的金属发生氧化还原反应
C.工业上通常用铝热反应来冶炼铁
D.苯酚与溴的反应很灵敏,常用于苯酚的定性检验和定量测定
E.用玻璃棒蘸取某溶液,放在火焰上灼烧,观察到火焰呈现黄色,则说明该溶液中含有Na+
F浓硫酸具有强氧化性,所以不能用浓硫酸来干燥H2S、SO2等还原性气体
Ⅱ、(南充市2008 届第二次适应性考试)某兴趣小组的学生共同设计了如图 16 所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
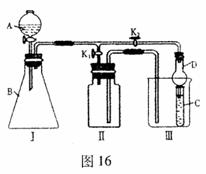 ( l )利用
I、II装置制取气体( K2关闭, K1打开),甲同学认为:利用II装置可以收集 H2、 NH3等气体。但不能收集 O2或 NO 等气体,其理由是__________________________________
( l )利用
I、II装置制取气体( K2关闭, K1打开),甲同学认为:利用II装置可以收集 H2、 NH3等气体。但不能收集 O2或 NO 等气体,其理由是__________________________________
______________________________________________。乙同学认为:将II装置作简单改进(不改变装置),也可收集 O2或 NO 等气体,但不能收集 NO2 气体,则改进的方法__________________________________
_______________________________________。将II装置再作简单改进(不改变装置),还可收集 NO2气体,则改进方法是__________________________________
_______________________________________。
( 2 )利用 I、II 装置能否验证氧化性: KMnO4> Cl2 > Br2___________(选填“能”或“不能” ) ,若不能,下列问题不做回答;若能,则在 A 中应加_____________, B 中应加_________________, C 中加人 NaBr 溶液, C 中可观察到的现象是_____________
_____________________,操作时应打开_________,关闭________(选填“K2”或“K1”)。
13.(湖北省鄂南高中2008训练题3)某有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相容性,是塑料工业主要增塑剂,可以用下列方法合成之:
已知: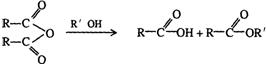
合成路线:
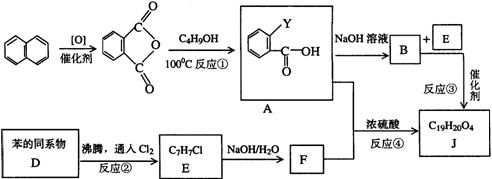
上述流程中:(ⅰ)反应 A→B仅发生中和反应,(ⅱ)F与浓溴水混合不产生白色沉淀。
(1)指出反应类型:反应② 反应④ 。
(2)写出结构简式:Y F 。
(3)写出B+E→J的化学方程式 。
(4)写出E的属于芳香烃衍生物的同分异构体的结构简式:
、 、 。
高三理综化学重组试题卷Ⅱ 4.9
1.C 2.D 3.C 4.B 5.A 6.C 7.D 8.A 9.D
10.(1)①b ②c ③a
(2)①HClO4
②离子键、(极性)共价键
NaClO
|
④H2O2+H2S=====S↓+2H2O
无色溶液中产生淡黄色浑浊
11.(1)Al2O3
(2)2Mg+CO2 = C+2MgO
![]() (3)AlO-+2H2O Al(OH)3(胶体)+OH-
(3)AlO-+2H2O Al(OH)3(胶体)+OH-
(4)2Na2O2+4H+=4Na++O2↑+2H2O
12.Ⅰ.AD
Ⅱ.(1)氢气与氨气的密度小于空气,而氧气的密度比空气大;
NO易与空气中的氧气反应;
将Ⅱ装置中加满水;
在Ⅱ装置中中加入难挥发,且不与NO2反应的有机溶剂
(2)能; 浓盐酸;KMnO4固体;溶液呈橙色;K2;K1
13. (1)取代 酯化
(2)![]()
![]()
(3)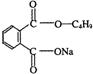 +
+![]()
![]()
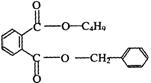 +NaCl
+NaCl
(4)![]()
![]()
![]()