08届高三期中化学试卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ试卷共8页,有22小题,满分为100分,考试时间90分钟。
2.本卷答案必须写在答题卡的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、分别填写在答题卡的相应位置上。考试结束后只需上交答题卡,考试时不能使用计算器。
4.本卷可能用到的相对原子质量: H:1 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64 Zn:65
★ 祝同学们考试顺利 ★
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48 分)
1.下列有关化学史实的叙述中不正确的是
A.原子分子学说的建立,是近代化学发展的里程碑
B.揭示物质世界的一项根本性的规律是元素周期律
C.侯德榜因发明联合制碱法而荣获诺贝尔化学奖
D.1965年我国科学家在世界上第一次用人工方法合成了结晶牛胰岛素
2.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.80 g NH4NO3晶体中约含有NH4+ 6.02×1023个
C.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
D.46 g NO2和N2O4混合气体中含有原子数约为1.806×1024
3.2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球—科学发展,构建和谐”。你认为下列行为中不符合这一主题的是
A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B.控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、
资源的循环再生(Recycle)
4.下列关于环境问题的说法正确的是
A.pH小于7.0的降水通常称为酸雨
B.燃煤时加入适量石灰石,可减少废气中的SO2
C.含磷合成洗涤剂易于被细菌分解,故不会导致水污染
D.推广使用乙醇汽油目的是为了消除汽车尾气对环境的影响
5.已知强酸与强碱在稀溶液里反应的中和热可表示为:
H+(aq) + OH—(aq) == H2O(l);△H = -57.3KJ/mol
CH3COOH(aq) + NaOH(aq) == CH3COONa(aq) + H2O(l);△H = -Q1KJ/mol
1/2H2SO4(浓) + NaOH(aq) == 1/2Na2SO4(aq) + H2O(l);△H =-Q2KJ/mol
HNO3(aq) + NaOH(aq) == NaNO3(aq) + H2O(l);△H =-Q3KJ/mol
上述反应均系在溶液中进行的反应,Q1、Q2、Q3的关系正确的是:
A.Q1> Q2= Q3 B. Q2 > Q1 > Q3
C.Q2 >Q3 >Q1 D. Q2 = Q3 > Q1
6.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.氧元素的氢化物只有H2O一种
![]() B.NH3分子的结构式为:
B.NH3分子的结构式为:
![]() C.HCl的电子式为:
C.HCl的电子式为:
D.同主族元素的氢化物沸点均随分子量增大而升高
7.下列离子方程式书写正确的是
A.等体积、等物质的量浓度的Ba(OH)2溶液与NaHCO3溶液混合 :
Ba2++2OH-+2HCO3-→BaCO3↓+CO32-+H2O
B.次氯酸钙溶液中通入少量SO2气体: Ca2++2ClO-+SO2+H2O→CaSO3↓+2HClO
C.NH4HCO3溶液与足量NaOH容液混合溶液混合:
NH4++HCO3-+2OH-→NH3·H2O+ CO32-+ H2O
D.明矾溶液中加入过量的Ba(OH)2溶液:
2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓
8.类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.工业上用电解熔融MgCl2制取金属镁,故也用电解熔融AlCl3的方法制取金属铝
B.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
D.第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
9.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的![]()
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
10.下列叙述不正确的是
A.硅是人类将太阳能转换为电能的常用材料
B.硅胶可用于某些气体和袋装食品的干燥剂
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.电流通过胶体时,胶体就会发生丁达尔现象
11.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为
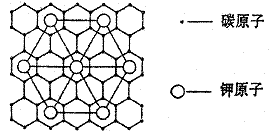 |
A、8 B、12 C、24 D、60
12.某溶液中加入铝粉有氢气产生,该溶液中肯定可以大量存在的离子组是
A.Na+、NO3-、Cl-、SO42- B.Na+、K+、Ba2+、HCO3-
C.Fe3+、H+、SO42-、Cl- D.Na+、K+、Cl-、SO42-
![]() 13.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g); △H>0,
13.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g); △H>0,
|
量不变),且造成容器内压强增大,下列说法正确的是( )
A.容器内气体颜色变深,混合气体密度增大
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.改变条件前后,速率图象为(如右图)
14.FeS2与HNO3反应后的氧化产物为Fe3+和H2SO4,若反应中FeS2与HNO3的物质的量之比为1︰8,则HNO3的还原产物为 ( )
A.NO2 B.NO C.N2O D.N2O3
15.关于化学键的说法正确的是
A、构成分子晶体的微粒一定含有共价键
B、由非金属元素组成的化合物不一定是共价化合物
C、非极性键只存在于双原子分子中
D、不同元素组成的多原子分子中的化学键一定是极性键
16.短周期元素X和Y的气态原子失去核心外不同电子所需的能量(KJ·mol-1)与锂比较如下:
| 失去第一个电子 | 失去第二个电子 | 失去第三个电子 | 失去第四个电子 | |
| 锂 | 519 | 7296 | 11799 | |
| X | 502 | 4570 | 6920 | 9550 |
| Y | 580 | 1820 | 2750 | 11600 |
则下列说法正确的是
A.X与锂同周期 B.Y与锂同周期 C.X与锂同主族 D.Y与锂同主族
08届高三期中化学试卷答题卡
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括1小题,共10分)
17.(10分)根据硫酸铜晶体结晶水含量的测定实验;填写下列空白
此实验操作顺序如下:①称量坩埚、晶体;②加热、冷却;③称量;④再加热、冷却;⑤称量;⑥计算;⑦分析实验误差。
(1)用托盘天平称量的时候,若指针偏向左边,则表示(填写正确选项代码) 。
A.左盘重,样品轻
B.左盘轻,砝码重
C.右盘重,砝砝轻
D.右盘轻,样品重
(2)在进行加热时,应该用 来夹持坩埚;为了防止硫酸铜晶体失去结晶水时不完全,或发生CuSO4强热分解,造成实验产生误差,所以在加热操作中要①______
, ② ____ 。
(3)加热后的坩埚应放在 中冷却。如果放在空气中自然冷却,则会使实验结果的误差偏 。
(4)在进行④、⑤两步实验时,有时还要重复进行,这是由于
。
(5)在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω=____________________(写计算式)。如果实验中加热温度过高,固体颜色变黑,则测定结果会____________(填“不变”、“偏高”、“偏低”)。
三、推断题(本题包括1小题,共8分)
18.A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,乙元素的氢化物水溶液显碱性。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。K为乙元素的单质。在适当的条件下,它们相互之间有如下图所示的转化关系:
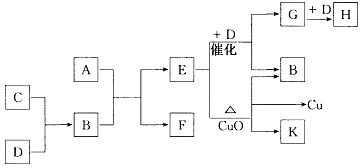
试填写下列空白:
(1)甲元素的单质在空气中燃烧可得到_____________________(填化学式至少写2种)。
(2)完成下列有关反应的化学方程式。
E + D→G + B:__________________________________________________。
E + CuO:_______________________________________________________。
四、填空题(本题包括3小题,共26分)
19.某无色溶液,可能由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干中组成。取该溶液进行以下反应:
⑴取适量试液,加入过量盐酸,有气体生成,并得到溶液;
⑵在⑴所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
⑶在⑵所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
(1)溶液中一定不存在的离子是______________________________________________;
(2)一定存在的离子是____________________________________________________;
(3)判断沉淀乙成份的方法是______________________________________________。
20.(10分)现有A、B、C、D四种短周期非金属元素,它们的主要化合价不止一种,但它们有一种相同的化合价。 它们一些物理常数如下:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 单质沸点/℃ | 444.6 | 4827 | 2355 | -195.8 |
(1)B和D最高价氧化物水化物的酸性强弱是(用化学式表示) >
(2)BA2化合物是由 (极性、非极性) 键构成的 (极性、非极性)分子。其分子空间构型是 。(直线型、V型、三角锥形、正四面体)
(3)D的氢化物与D的最高价氧化物水化物发生反应离子化学方程式
(4)单质B与元素C的氧化物在一定条件下相互反应的化学方程式 ,
由此证明非金属性是 大于 。
(5)与D同主族的短周期元素E单质E4与氯气的物质的量之比为1:8,则它的总化学反应式
是
21.某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是 。
(2)若该反应方程式是I2和KIO3的化学计量数都是5,则KMnO4的化学计量数
是 。请在下面的化学式上标出电子转移的方向和数目。KMnO4+KI+H2SO4→
(3)若不限定某些物质的计量数,可能配平的化学计量数有许多组,原因是
。
五、计算题(本题包括1小题,共8分)
22. (8分) 6.4克铜与过量硝酸(a mol/L ,30mL)充分反应,硝酸的还原产物只有NO2、NO,反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol
(2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)
[注:无解题过程不给分]
08届高三期中化学试卷参考答案
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | C | C | B | C | B | C | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | D | A | B | D | B | B | C |
第Ⅱ 卷(非选择题,共52分)
二、实验题(本题包括1小题,共10分)
17. (1) D;(2)坩埚钳;①不断用玻璃棒搅拌;②用小火加热,防止温度过高;(3)干燥器 偏小;(4)保证结晶水完全失去,提高实验的准确度。(5)![]() ×100% 偏高
×100% 偏高
三、推断题(本题包括1小题,共10分)
18.(1)Mg3N2、MgO、C
(2)4NH3 + 5O2![]() 4NO + 6H2O
4NO + 6H2O
2NH3
+ 3CuO![]() 3Cu + 3H2O + N2
3Cu + 3H2O + N2
四、填空题(本题包括3小题,共32分)
19.(1)MnO4- ,Ag+、Ba2+、Al3+
(2)CO32- ,Na+ ,AlO2-
(3)加入盐酸,观察沉淀是否全部溶解
20.(1) HNO3>H2CO3 (2)极性、非极性、直线型
(3)NH3 + HNO3 = NH4 NO3 (4)2C +SiO2 = Si +2CO,碳,硅(5)P4+8Cl2=2PCl3+2PCl5
21. (1)KMnO4(1分) (2)8 (2分)![]() (2分)
(2分)
(3)该反应可看作两个氧化还原反应的加和,加和时两个反应的比例可发生变化(2分)
五、计算题(本题包括1小题,共8分)
22.(8分)⑴ 0.3 (4分)
⑵ n(NO)= 0.045a-0.55 n(NO2)=0.025-0.015a (4分)