08届第三次月考化学试卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ试卷共8页,有22小题,满分为100分,考试时间90分钟。
2.本卷答案必须写在答题卡的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、分别填写在答题卡的相应位置上。考试结束后只需上交答题卡,考试时不能使用计算器。
4.本卷可能用到的相对原子质量: H:1 N:14 O:16 Na:23 Mg:24 Al:27
S:32 Cl:35.5 Fe:56 Cu:64 Zn:65
★ 祝同学们考试顺利成功 ★
第Ⅰ卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
1.苹果汁是人们喜爱的饮料,由于其中含有亚铁离子,在榨取后不久往往会变为棕黄色,生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的
A.氧化性 B.还原性 C.酸性 D.碱性
2.下列有关物质分类的说法正确的是
A.O2和O3、H2和D2、H![]() O和H
O和H![]() O都互为同素异形体
O都互为同素异形体
B.纯碱、烧碱、碱式碳酸铜都属于碱类物质
C.煤、石油和天然气都属于化石能源
D.CH2Cl2、CH4O、C2H4O2一定是纯净物
3.法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳-碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应 。烯烃复分解反应可形象地描述为交换舞伴。(如图所示)

烯烃复分解反应中的催化剂是金属卡宾(如CH2==M),金属卡宾与烯烃分子相遇后,两
对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,
其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃
分子,再次“交换舞伴”。把C6H5CH2CH==CH2与CH2==M在一定条件下混合反应,下列
产物不可能存在的是
A. C6H5CH2CH==M B. CH2= CH2
C. C6H5CH2 CH2 C6H5 D. C6H5CH2CH==CH CH2 C6H5
4.类推的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论,因此类推出的结论最终要经过实践的检验才能确定是否正确。以下几种类推结论中正确的是
A.CaCO3的溶解度小于Ca(HCO3)2,推出Na2CO3溶解度小于NaHCO3
B.NH3的沸点高于PH3,推出CH4沸点高于SiH4
C.H2SO4为强酸,推出HClO4为强酸
D.碳的+4价化合物稳定,推出铅的+4价化合物稳定
5.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
6.能正确表示下列反应的离子方程式是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B.氨水中通入少量二氧化碳 NH3·H2O+CO2==NH4++CO32-+H2O
C.碳酸钠溶液中逐滴加入等物质的量的乙酸
CO32-+2CH3COOH== CO2↑+H2O +2CH3COO-
D.硫酸铁的酸性溶液中通入足量硫化氢 Fe3++H2S== Fe2++S↓+2H+
7.NA代表阿伏加德罗常数,下列说法正确的是
A.1 mol CH5+(碳正离子)中含有的电子数为11NA
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
C.质量相等、密度不等的N2和C2H4,两种气体所含的分子数不相等
D.室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA
8. CH3—CH—CH—CH2—CH—CH3的系统命名是
CH3 CH2—CH3 CH3
A.2,5—二甲基—4—乙基己烷 B.2,5—二甲基—3—乙基己烷
C.3—异丙基—5—甲基己烷 D.2—甲基—4—异丙基己烷
9.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
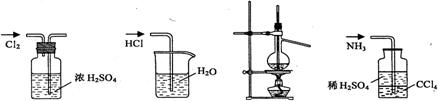
A 干燥Cl2 B 吸收HCl C 石油的蒸馏 D 吸收NH3
10.常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②=③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
11.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
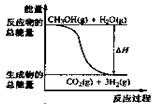 ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
12.对于Al与重氢氧化钠(NaOD)的水溶液反应,下列说法正确的是
A.生成的氢气中只含有D2 B.生成的氢气中含有H2、HD、D2
C.生成的氢气中只含有H2 D.以上判断都不正确
13.常温下,下列各溶液的叙述中正确的是
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0. 1mol/L的盐酸的pH=b,则a<b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
14.下列实验中,仪器的下端必须插入液面下的是
①制备氢气的简易装置中的长颈漏斗; ②制备氯气装置中的分液漏斗;③制备Fe(OH)2操作中的胶头滴管; ④将氯化氢气体溶于水时的导管 ⑤用乙醇制取乙烯时的温度计;⑥分馏石油时的温度计
A.①③⑤ B.②④⑥ C.①③④⑤ D.全部
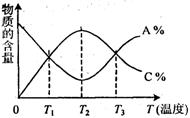 15.已知可逆反应aA+bB
15.已知可逆反应aA+bB ![]() cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到化学平衡
C.升高温度,平衡会向正反应方向移动
D.该反应的正反应是吸热反应过
16.用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2 L标准状况下的气体,原溶液中Cu2+的物质的量浓度为
A、0.5 mol/L B、1 mol/L C、2 mol/L D、无法确定
08届第三次月考化学答题卡
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括1小题,共15分)
17.(15分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
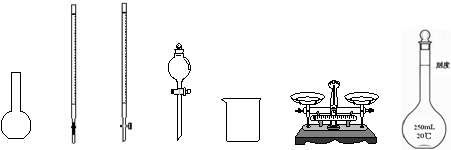 |
A B C D E F G
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是
。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再此加热并冷却室温称量其质量为m2g,且m1-m2=0.3,接下来的操作应当是
。
(5)若坩埚质量是W1,坩埚于加热后固体总质量是W2,则样品中铁元素的质量分数为
。(列出算式,不需化简)
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到目的。你认为甲学生的观点是否正确,请说明理由:
。
三、填空题(本题包括3小题,共32分)
18.(4分)
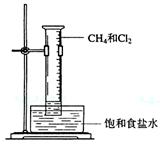
|
和Cl2,倒置在饱和食盐水中,用漫散光照射。实验
中可观察到的现象有:
(2)实验中用饱和食盐水而不用水的原因是:
19.(8分)下图是常见无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,B和C都是极易溶于水的气体,C与AgNO3溶液反应生成不溶于稀硝酸的白色沉淀,E是一种红棕色气体,I是红褐色沉淀,K是由第三周期元素组成的单质中熔点最高的金属。
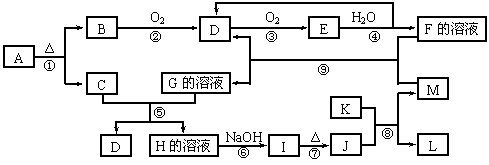
请填写下列空白:
⑴ B分子的电子式为____________________________
⑵ 写出反应⑧在工业生产上的一种用途_______________________________。
⑶ 检验G溶液中阳离子的方法是________________________________________。
⑷反应⑤的离子方程式是:__________________________________________。
20.(8分)今有一混合物的水溶液,只可能含有以下离子中的若干种: K+、 NH4+、 Cl-、
Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,确定一定存在的离子是 ;可能存在的离子是 ;一定不存在的离子是
。
21.(10分)已知下列几种烷烃的燃烧热如下:
| 烷 烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/(kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ。
⑴试写出乙烷气体燃烧的热化学方程式 ;
⑵计算该天然气中甲烷的体积分数
⑶由上表可总结出的近似规律是____________________
_。
四、计算题(本题包括1小题,共7分)
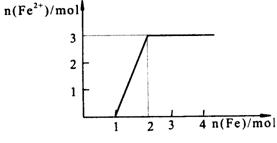
22.(7分) 向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入Fe粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示
|
(1)写出相关的反应的离子方程式。
(2)原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为
08届第三次月考化学参考答案
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | C | C | C | A | A | D | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | B | D | B | B | A | B | B |
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括1小题,共12分)
17.(15分)
(1)C F G(2分)(对1个不给分,对2个1分,对3个2分)
(2)2Fe2+ +Cl2=2Fe3++2Cl- (2分)
(3)NH![]() 、Cl-、OH-(2分);向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次。
(2分)
、Cl-、OH-(2分);向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次。
(2分)
(4)继续加热,放置干燥器中冷却,称量,至最后两次称得的质量不超过0.1g为止。(2分)
(5)![]() ×2×56g/mol×
×2×56g/mol×![]() ÷
÷![]() g×100%
(2分)
g×100%
(2分)
(6)正确(1分),FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,对实验结果无影响。 (2分)
三、填空题(本题包括3小题,共32分)
18.(1)量筒中液面上升;量筒内壁上有油状液滴;气体颜色变浅,水槽中有晶体析出。(2分,只要答出前两项即可2分)
(2)减小氯气在水中的溶解度,防止Cl2溶解而影响实验。(2分)
19.(8分,每空2分)
⑴ ![]() ⑵ 冶炼难熔金属或野外焊接钢轨
⑵ 冶炼难熔金属或野外焊接钢轨
⑶取少量G溶液于试管中,加入KSCN溶液无现象,再加入氯水后溶液变红色
⑷ 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
20.(8分) 一定存在NH4+ 、K+ 、CO32-、SO42- ;(4分)
可能存在Cl-; (2分)
一定不存在Ba2+、Mg2+(2分)
|
⑵72% (4分)
⑶烷烃分子中每增加一个CH2,燃烧热平均增加660kJ/mol 左右(3分)
四、计算题(本题包括1小题,共8分)
22(6分)
(1)4H++NO3-+Fe= Fe3++NO↑+2H2O (2分) 2Fe3++ Fe=3Fe2+ (2分)
(2) 4:1 (2分)