08届高三第二次月考化学试卷
化 学 试 卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ试卷共8页,有22小题,满分为100分,考试时间90分钟。
2.本卷答案必须写在答题卡的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、分别填写在答题卡的相应位置上。考试结束后只需上交答题卡,考试时不能使用计算器。
4.本卷可能用到的相对原子质量: H:1 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64 Zn:65
★ 祝同学们考试顺利 ★
第Ⅰ卷(选择题,共48分)
一、选择题(本题共8小题,每小题3分,共24分,只有一个正确选项。)
1.有人认为,人体实际上是一架缓慢氧化着的“高级机器”,人体在生命进程中也需要不断地补充“燃料”。按照这种说法,你认为人们通常摄入的下列物质不能看作“燃料”的是
A.淀粉 B.水 C.脂肪 D.蛋白质
2.下列说法正确的是:
A、化学式符合XOH(X代表某一元素)的物质一定是碱
B、分子式为C6H6的物质一定是苯
C、最简单的烯烃一定是乙烯
D、含碳量最高的烃一定是乙炔
3.若![]() 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
A.0.84
g![]() 晶体中阳离子和阴离子总数为0.03
晶体中阳离子和阴离子总数为0.03![]()
B.a g![]() 和
和![]() 的混合气体中所含分子数一定为
的混合气体中所含分子数一定为![]()
C.标准状况下,2.24 L四氯化碳含碳原子数为0.1![]()
D.1.8 g ![]() 含有的质子数为
含有的质子数为![]()
4.下列实验现象描述不正确的是 ( )
| 编码 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先融化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔融化,失去光泽,融化的铝并不滴落,好像一层膜兜着 |
| C | 在空气中久置的铝条放入NaOH溶液中 | 铝条立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
5.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.②⑤ C.①②④ D.②③④⑤
6.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g) ;△H>0
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ;△H<0
C.Ba(OH)2·8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(l)+8H2O(l); △H>0
D.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) ;△H<0
7.下列有关化学实验的操作或说法中,正确的是
A.配制氯化铁溶液时,先将氯化铁溶于浓盐酸,再用蒸馏水稀释并加入适量铁粉
B.将浓硫酸在量筒中稀释
C.用银氨溶液检验蔗糖水解产物时,先加入适量NaOH是为了中和稀H2SO4
D.用固体NaOH与NH4Cl混和,在玻璃试管中加热制NH3
8.某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.K+、Na+、AlO2-、NO3- B.Mg2+、Al3+、HCO3-、SO32-
C.K+、Ca2+、MnO4-、Cl- D.NH4+、Fe3+、SO42-、SCN-
9.能正确表示下列反应的离子方程式是
A.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++4H2O+NO↑
B.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+=Fe2++S↓+2H+
C.醋酸溶液与纯碱反应:CO32- +2H+=+H2O+CO2↑
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:
 Ba2++OH-+H++SO42-=BaSO4↓+H2O
Ba2++OH-+H++SO42-=BaSO4↓+H2O
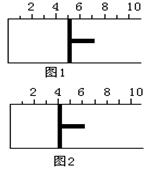
10.如右图所示,一定条件下将1mol A2气体和3molB2气体充入一
容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在
![]() 恒温恒压下发生如下反应:A2(g)+3B2(g)2AB3
恒温恒压下发生如下反应:A2(g)+3B2(g)2AB3
(g)。当反应达到平衡时,活塞位置如图2所示,则平衡时A
的转化率是
A.20% B.60% C.40% D.无法确定
11.关于物质的检验,下列判断正确的是 ( )
A.加入适量氯水,再滴加KSCN溶液后有血红色物质生成,则原溶液中一定有Fe3+存在
B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在
C.某溶液做焰色反应时火焰为黄色,则该溶液中一定有钠元素,没有钾元素
D.MgCl2、CuCl2、FeCl2和AlCl3四种盐溶液,只用NaOH溶液能一次鉴别开来
12.铊 (Tl) 是某超导材料的组成元素之一,与铝同族,位于第六周期。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+ 。下列推断正确的是
A.Tl+的最外层有一个电子 B.Tl3+ 的氧化性比Al3+ 弱
C.Tl能形成+3价和+1价的化合物 D.Tl+ 的还原性比Ag强
13.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟氯气反应除生成C外,另一产物是盐酸盐。下列说法不正确的是
A![]()
A. 当X是强酸时,ABCDEF均含有一种元素,F是硫酸
B. 当X是强碱时,ABCDEF均含同一种元素,F是硝酸
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C常温下是气态单质
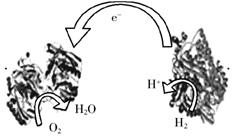 14.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
14.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
A.左边为该电池的负极 B.该电池可在高温环境下使用
C.该电池负极反应为:H2—2e-=2H+ D.该电池正极反应为O2+4e-=2O2-
15.有一氧化铁样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,亚铁离子全部转变为铁离子,则该氧化物可能的化学式为
A.Fe 2O 3 B. Fe 3O 4 C.Fe 4 O5 D.Fe 5O 7
16.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+))>c(Cu2+)>
c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+) =c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>
c(H+)>(OH-)
齐齐哈尔市2008届高三第二次月考化学答题卡
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
三、包括3小题,共 22 分
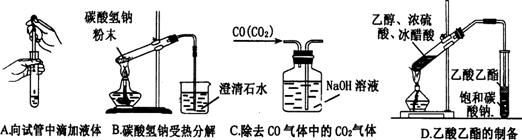
17.(6分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有________________________。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将pH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.附着于试管内壁上的硫,可用热碱液洗涤
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
(2)下列实验没有错误的是_______________________。
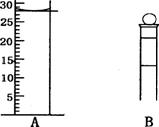
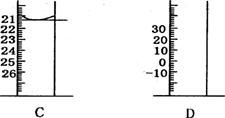
(3)下图为常见仪器的部分结构(有的仪器被放大)
A图中液面所示溶液的体积为_____________mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是________(填字母标号)。
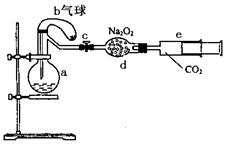 18.(10分)下图所示装置中,a是盛有标况下224 mL空气 (氧气占五分之一)和10 mL 1.2
mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384 g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
18.(10分)下图所示装置中,a是盛有标况下224 mL空气 (氧气占五分之一)和10 mL 1.2
mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384 g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反 应后发现铜粉有剩余(设产生的气体不溶解于溶液中),则可观察到的现象是___________________。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施,若用加入化学试剂法,下列试剂中可以使用的是(填代号)________________________。
A.蒸馏水 B.无水醋酸钠 C.石墨 D.硝酸银(少量)
(3)将烧瓶充分振荡,所观察到的现象是____________________________;有关反应的化学方程式__________________________________________________。
(4)打开弹簧夹c,将二氧化碳推入干燥管内,使反应充分进行。将烧瓶中反应的全过程用一个总的化学方程式表示:_______________________________________。
(5)欲使所有的铜粉都溶解,至少需要推入二氧化碳_________mL(设推入的二氧化碳全部反应)。
19.(6分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO![]() 六种离子。
六种离子。
(1).甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 、 、 。
(2).乙厂的废水中含有另外三种离子。如果加一定量 (选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属 (填写金属元素符号)。
(3).另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
四、包括2小题共18分
20、(8分)已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:(有部分物质省略)
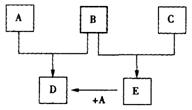
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为_____,写出A+E→D的化学反应方程式___________________________________________。
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为______,写出A+E→D的化学反应方程式 ______________________________________________。
(3)若常温下B为气体,C为黑色固体,则金属A的原子结构示意图为______,写出A+E→D的化学反应方程式____________________________________________。
21.(10分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的是
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号
及实验中观察到的现象:
| 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行?
理由是:
根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是
写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:
五、包括2小题,共12分
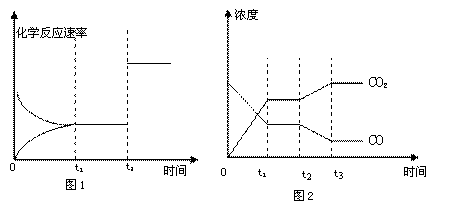
22.(4分)(1)现有反应CO2(g)
+ H2(g)![]() CO(g) + H2O(g)要使反应在一定条件下建立的平衡向正反应方向移动,可采取的措施有 (填写序号)。
CO(g) + H2O(g)要使反应在一定条件下建立的平衡向正反应方向移动,可采取的措施有 (填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)下图1、2表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
① 图1中t2时刻发生改变的条件是 。
② 图2中t2时刻发生改变的条件是 。
 |
23.(8分)将5。1 g镁铝合金溶于60 mL
5mol·L![]() H2SO4溶液中,完全溶解后再加入65
mL10.0 mol·L
H2SO4溶液中,完全溶解后再加入65
mL10.0 mol·L![]() 的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少。
的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少。
(1)当加入________mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。
08届高三第二次月考化学参考答案
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | C | D | C | B | B | C | A |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| D | C | D | C | D | C | D | D |
17、(6分)
(1)A EFH(2分.选对1个得1分.选错、多选1个倒扣1分.本题不出现负分)
(2)D(2分)
(3)28.0(1分) C(1分)
18、(10分)
(1)溶液逐渐变蓝,烧瓶中气体逐渐变为红棕色,气球变大 (2分)
(2)C D (2分)
(3)气球体积变小,瓶内气体颜色变浅 3NO2+H2O=2HNO3+NO (2分)
(4)2Cu+4HNO3+O2=2Cu(NO3)2+2H2O (2分)
(5)44.8 (2分)
19、(6分)OH-,Cl-,K+;铁粉; Ag(或银);Ag+,Fe3+,Cl-,OH-; KNO3(2分)
20、(10分)(1) E:CuO,(1分)H2+CuO![]() Cu+H2O。 (1分)
Cu+H2O。 (1分)
(2) E:![]() (1分),3Fe+4H2O(g)
(1分),3Fe+4H2O(g) ![]() Fe3O4+4H2。 (2分)
Fe3O4+4H2。 (2分)
(3) A: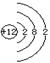 (1分),2Mg+CO2
(1分),2Mg+CO2![]() 2MgO+C。(2分)
2MgO+C。(2分)
21、(10分)(1)Br2;Fe3+ (2分)
| (2) 乙 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | C | 有机层无色 |
| 第二种方法 | D | 溶液变红 |
(3)不可以,因为Br2和Fe3+都能把I—氧化成I2 , Fe2+; 2 Fe2+ + 4 Br- + 3Cl2 === 2 Fe3+ +2 Br2 + 6Cl-
22、(1)D、F (2分)
(2)① 加入催化剂或增大体系的压强(2分,写出一个给1分)
② 降低温度或增加水蒸汽的量或减少氢气的量(1分)
23、(8分)(1)60 (2分)
(2)设合金中含有Mg,Al的物质的量分别为x、y,
则24g·mol![]() ×x+27g·mol
×x+27g·mol![]() ×y=5.1 g ①
(1分)
×y=5.1 g ①
(1分)
当加入的OH![]() 与原来H
与原来H![]() SO
SO![]() 溶液中的H
溶液中的H![]() 的物质的量相等时,Mg
的物质的量相等时,Mg![]() 、Al
、Al![]() 恰好沉淀完全,此时加入的NaOH溶液的体积为60×10
恰好沉淀完全,此时加入的NaOH溶液的体积为60×10![]() L×5.0 mol·L
L×5.0 mol·L![]() ×2÷10 mol·L
×2÷10 mol·L![]() =0.06 L=60 mL,再多加5 mL NaOH溶液所溶解的Al(OH)
=0.06 L=60 mL,再多加5 mL NaOH溶液所溶解的Al(OH)![]() 的质量为
的质量为
5×10![]() L×10 mol·L
L×10 mol·L![]() ×78 g·mol
×78 g·mol![]() =3.9 g,即沉淀的最大值为3.9g+9.7g=13.6 g
=3.9 g,即沉淀的最大值为3.9g+9.7g=13.6 g
(2分)
故有58g·mol![]() ×x+78 g·mol
×x+78 g·mol![]() ×y=13.6 g ②
(1分)
×y=13.6 g ②
(1分)
由①②解得x=0.1
mol,y=0.1 mol,故产生H![]() 的物质的量为
的物质的量为
0.1 mol+0.1×1.5 mol=0.25 mol
故V(H![]() )=0.25 mol×22.4 L·mol
)=0.25 mol×22.4 L·mol![]() =5.6 L
(2分)
=5.6 L
(2分)