08届高三年级上学期第二次联考试卷
化 学
命题人:宁乡一中 黄建波 桃江一中 詹奇寿 南县一中 魏东初
时量:90分钟 满分:100分
请将答案写在答题卷上
可能用到的原子量:H:1 O:16 C:12 N:14 Si :28 Fe:56 Cl:35.5 Na:23 F:19
一、 选择题(每题只有一个正确选项,每小题3分,共48分)
1. 有关化学用语正确的是
A. 次氯酸钙的化学式Ca(ClO)2 B. 乙酸的结构简式C2H4O2
![]()
![]() C. 氮气的电子式N N
D. 臭氧的化学式 18 8O
C. 氮气的电子式N N
D. 臭氧的化学式 18 8O
2.既含有极性键又含有非极性键的非极性分子是
A.H2O2 B.Na2O2 C.C2H2 D.C2H5OH
3.下列物质的保存方法正确的是
A.氢氟酸保存在塑料盖的玻璃瓶中 B.氯水盛放在棕色细口瓶中
C.液溴盛放在用橡皮塞的玻璃瓶中 D.固态碘放在棕色的细口瓶中
4.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在C(H+)=10—13mol/L的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
5.下列反应离子方程式正确的是
A.Fe2(SO4)3的酸性溶液中通入足量硫化氢:Fe3++H2S=Fe2++S↓+2H+
B.碳酸氢钙溶液中加入过量氢氧化钠溶液 Ca2++HCO3-+OH_=CaCO3↓+H2O
C.氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
D.澄清石灰水中通入过量CO2:OH-+CO2=HCO3-
6.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3 ×6.02×1023
B.0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5 gSiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
7.某溶液中含有NO3—、SiO32—、AlO2—、S2—等4种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
A.只有S2— B.S2—和NO3— C.SiO32—、S2—和NO3— D.四种离子都减少
8.周期元素W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族.W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍。下列叙述中不正确的是
A.WX2分子中所有原子最外层都为8 电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合的非极性分子
D.原子半径大小顺序为X <W<Y<Z
9.下列离子检验的结论可靠的是
A.往溶液中加入过量的氯水再加淀粉,不出现蓝色,说明一定没有I-
B.往溶液中加入氯水,再加CCl4,CCl4层呈红棕色,说明有Br-
C.往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32-
D.往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明有SO42-
 10.超导材料YBa2Cu3Ox中Y为+3价,Ba为+2价,Cu为+2、+3混合价态,其中+2价的Cu与+3价的Cu的物质的量之比为18∶7,则x的值为
10.超导材料YBa2Cu3Ox中Y为+3价,Ba为+2价,Cu为+2、+3混合价态,其中+2价的Cu与+3价的Cu的物质的量之比为18∶7,则x的值为
A.6.50
B.6.92
C.8.00
D.8.05
11.右图是制取和收集某气体的实验装置,可用于
A.用Zn粒与稀HCl反应制H2
B.用Na2O2与H2O反应制O2
C.用Cu与稀HNO3反应制NO
D.用MnO2与浓HCl反应制Cl2
12.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)由大到小的顺序是
A、p(Ne)>p(H2) >p(O2) B、p(O2) >p(Ne)>p(H2)
C、p(H2)>p(O2) >p(Ne ) D、p(H2)>p(Ne)>p(O2)
13.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1:7 B.1:9 C.1:5 D.2:9
14.在烧杯中加水和苯(密度:0.88 g/cm3)各50 mL。将一小粒金属钠(密度:0.97 g/cm3)投入烧杯中。观察到的现象可能是
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能作上、下跳动
15.下列有关热化学方程式的表示及说法正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为 241.8kJ/mol
B.已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+1/2H2SO4 (aq)=NaCl(aq)+H2O(l);△H=-57.4kJ/mol
D.己知I2(g)+ H2(g)=2HI(g);△H1 I2(s)+ H2(g)=2HI(g);△H2 则△H1>△H2
16.要配制浓度约为2 mol·L-1 NaOH溶液100mL,下面的操作正确的是
A. 称取4g NaOH固体,放入250mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B. 称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C. 称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D. 用100 mL量筒量取40 mL 5 mol·L-1NaOH溶液,倒入250 mL烧杯中,再用同一量筒取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
二、非选择题(每空2分,共52分)
17、(8分)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
① KMnO4 + KF + H2O2 + HF → K2Mn F6 + ____________ + H2O
② SbCl5 + HF → SbF5 + ____________
③ 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为______________。
(2)完成反应②: 。
(3)反应③中的氧化剂为__________________,被氧化的元素__________。
18、(6分)组成X、Y、Z 3种化合物的所有元素是第一第二周期元素,A、B是单质,在一定条件下,它们有如下反应(已配平):
A + X === B + Y X + Y === Z + B A + Z ==== 2Y
(1)X、Y各是什么物质:X ;Y ;
(2)某金属在一定条件下能与Z发生置换反应,该反应方程式为:
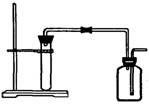
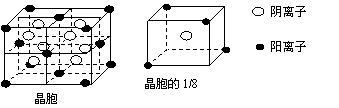 19、(10分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示:
19、(10分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示:
(1)C元素是
(2)A和E所形成的化合物的电子式是
(3)A、B、C、D四种元素的离子半径由小到大的
顺序为 (用离子符号表示)
(4)A和D的氢化物中,后者沸点较低,原因是
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数) 。
20、(8分)根据下图所示转化顺序及实验现象回答问题。已知D、G焰色反应为紫色(隔蓝色钴玻璃),A、E含有同种阴离子。C、F为同主族单质,其它与反应无关的物质已略去。
(1)写出A~Y各是什么物质(填化学式)
E: ; X:
(2)写出①、③对应的离子方程式:
① ③
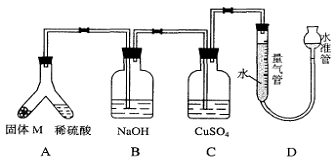 21、(14分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)。由上述实验事实可知:
21、(14分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)。由上述实验事实可知:
(1)①固体M中一定有的物质是_________(填化学式)
②M中一种物质的质量可以确定为_________g(用代数式表示)。
(2)写出B装置中反应的离子方程式 。
(3) C装置的作用是_________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
(6)D装置中在读取气体的体积时,除了要使所得气体的温度冷却到常温,还应注意的问题是: 。
22、(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。




化 学(答卷)
一、选择题(每题只有一个正确选项,每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、非选择题(每空2分,共52分)
17、(1)反应①中空格上应填物质的化学式为____ ___ 。
(2)完成反应②: 。
(3)反应③中的氧化剂为_ _,被氧化的元素为
18、(1)
(2)
19、(1) ( 2 ) (3)
(4) ;
(5)
20、(1)A: F:
(2)①
③
21、(1)① ②
(2)
![]() (3)
(3)
(4)
(5)
(6)
22、1) (2) (3)