08届高三年级化学第一次教学质量检查考试
化 学
考试时间:120分钟 满分:100分
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
|
|
|
|
|
|
选择题(本题包括22小题,每小题2分,共44分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
说明:(1)本试卷分为第I卷(选择题)和第II卷(非选择题)两部分。
(2)答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
(3)每小题选出答案后,用铅笔把答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,在选涂正确答案,不能答在试题卷上。
(4)未使用答题卡的考生,将各题选出的答案序号填写在上面表格内。
答题时可能用到的数据:H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5
P:31 Fe:56 Mn:55 Cu:64 Ag:108 I:127 Ba:137
| 得分 | 评卷人 |
|
|
|
第I卷 选择题(共44分)
一、选择题(每小题只有一个选项符合题意,本题包括22小题,每小题2分,共44分。)
1、从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了它存在的证据。若该氧分子具有空间对称结构,你认为该氧分子是
A、氧元素的一种同位素
B、臭氧的同素异形体
C、一种新的氧化物
D、可能是极性键构成的极性分子
2、韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。下列关于“暖冰”的说法不正确的是
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
3、NA代表阿伏加德罗常数,下列说法正确的是
A、9gD2O中含有的电子数为5NA
B、气体摩尔体积是指在标准状况下1 mol任何气体所占的体积
C、1molCH4分子中共价键总数为4NA
D、7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA
4、在101kPa时,燃烧1t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98*106kJ的热量,表示上述反应的热化学方程式正确的是 ( )
A. ![]()
B. ![]()
C. ![]()
D. ![]()
5、发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g);ΔH>0
B.Ba(OH)2·8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(l)+8H2O(l);ΔH>0
C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g);ΔH<0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH<0
6、下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
(A)在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多
(B)同价态的阳离子,甲比乙的氧化性强
(C)甲能跟稀盐酸反应放出氢气而乙不能
(D)将甲、乙作电极组成原电池时,甲是正极
7、下列物质中所有原子均满足最外层8电子结构的化合物是( )
A.PCl5 B.P4 C.CCl4 D.NH3
8、下列各物质中,按熔点由高到低的顺序排列的是
A、H2Te > H2Se > H2S > H2O
B、KCl>NaCl>LiCl>HCl
C、Sr>Ba>Ca>Be
D、金刚石>SiC>晶体硅
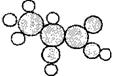 9、如图是一种有机物的比例模型。该模型代表的有机物可能是
9、如图是一种有机物的比例模型。该模型代表的有机物可能是
A.羟基羧酸 B.饱和一元醇
C.羧酸酯 D.饱和一元醛
10、下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、MnO4-、SO42-
②使pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、SO32
⑤酸性溶液:Fe2+、Al3+、NO3-、I-、Cl-
A.①⑤ B.①③ C.②④ D.①②
11、下列各组液体混合物,能用分液漏斗分离的是
A、溴苯和溴 B、正己烷和水 C、苯和硝基苯 D、乙醇和水
12、下列反应的离子方程式正确的是
A、次氯酸钙溶液中通入过量二氧化碳:Ca2+ + 2ClO- + H2O + CO2 = CaCO3↓ + 2HClO
B、硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O
C、用氨水吸收少量二氧化硫:NH3·H2O + SO2 = NH4+ + HSO3-
D、硝酸铁溶液中加过量氨水:Fe3+ + 3NH3·H2O = Fe(OH)3↓ + 3NH4+
13、最近科学家冶炼出了纯度高达99.9999%的铁,据你推测,下列性质它不可能具有的是( )
A.硬度比生铁低 B.在潮湿空气中放置不易生锈
C.在冷的浓硫酸中可钝化 D.与4 mol·L-1盐酸反应的速率比生铁快
14、把1L0.1mol/L醋酸溶液用蒸馏水稀释到10L,下列叙述正确的是
A、C(CH3COOH)变为原来的1/10 B、C(H+)变为原来的1/10
C、C(CH3COO-)/C(CH3COOH)的比值增大 D、溶液的导电性增强
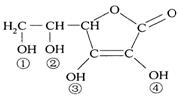 15、维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品和饮料的添加剂(如苹果汁等),其结构如右图。下列有关说法中正确的是
15、维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品和饮料的添加剂(如苹果汁等),其结构如右图。下列有关说法中正确的是
A.维生素C的分子式为C6H10O6
B.维生素C由于含有酯基而难溶于水
C.维生素C由于含有C=O键而能发生银镜反应
D.维生素C的酸性可能是③、④两个羟基引起的
16、足量铜与一定量浓硝酸反应,得到硝酸铜和NO2、N2O4、NO的混合气体,这些气体与1.68LO2 (标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A. 60mL B. 45 mL C. 30mL D. 15mL
17、用铂作电极电解某金属氯化物MCln的水溶液,当阳极产生amol气体时,阴极析出mg该金属,则金属的相对原子质量是( )
A.2ma/n B.2na/m C.mn/2a D.an/m
18、一定条件下,在可变容积的密闭容器中进行下列可逆反应
S2Cl2(l)+ Cl2(g)![]() 2SCl2(l);△
H= - 51.16 kJ/mol
2SCl2(l);△
H= - 51.16 kJ/mol
浅黄色 鲜红色
下列说法正确的是( )
A、达到平衡时,抽出少量氯气,反应混合液颜色变浅
B、单位时间内生成2nmolS2Cl2,同时生成nmol SCl2时,平衡向逆方向移动
C、达平衡时,降低温度,混合液的颜色将变浅
D、单位时间内有nmolCl2被还原,同时氧化生成nmol Cl2时,平衡向正反应方向移动。
19、下列说法中正确的是
A、把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用.
B、在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C、稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应.
D、硫化亚铁不能存在于盐酸中,而硫化铜能存在于盐酸中.
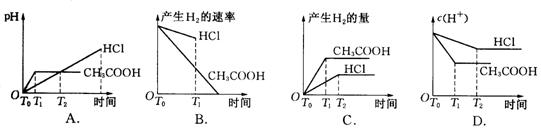
20、在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是
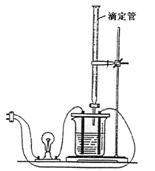
21、利用右图装做下面的实验:在烧杯里盛半杯乙溶液,
然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入
甲溶液,电灯又会逐渐亮起来。下列各组溶液中
(甲在前,乙在后),能够产生上述现象的是
A、NH3·H2O、AgNO3
B、CH3COOH、NH3·H2O
C、NaOH、AlCl3
D、H2SO4、Ba(OH)2
22、常温时,将![]() 的氨水滴加到
的氨水滴加到![]() 的盐酸中,下述结论中正确的是
的盐酸中,下述结论中正确的是
A、若混合溶液的pH=7,则![]()
B、若![]() ,
,![]() ,则混合液中
,则混合液中![]()
C、若混合液的pH=7,则混合液中![]()
D、若![]() ,且混合液的pH<7,则一定有
,且混合液的pH<7,则一定有![]()
第Ⅱ卷 非选择题(共56分)
| 得分 | 评卷人 |
|
|
|
二、本题包括2小题,共18分
23、某无色溶液,由Na+、Ag+、Ba2+、Al3+、、、、中的若干种组成。取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
⑴ 溶液中一定不存在的离子是 。
⑵ 一定存在的离子是 。
⑶请你写出判断沉淀乙成份的方法和步骤是
24、如图为常用玻璃仪器组成的七种实验装置,根据需要可在其中加入液体或固体试剂。请选择适宜装置的序号填于空白处。(多选、漏选或错选均扣分)
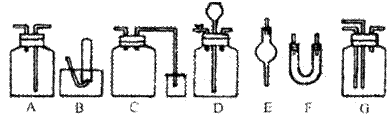
(1)既能用于收集Cl2,又能用于收集NO的装置是__________;
(2)能用作干燥CO2气流的装置是__________;
(3)在实验室制取C12并检验C12性质的连续实验中,用于除去Cl2中的HCl杂质的最佳装置是
__________;
(4)合成氨实验中,可用于干燥、混合并能大致观察H2和N2的体积比的装置是__________;
(5)用于尾气吸收并能防止液体倒吸到反应装置中的是__________;
(6)接在气体的连续实验中间,用于达到控制气流使其平稳目的的装置是__________。
| 得分 | 评卷人 |
|
|
|
三、本题包括2小题,共18分
25、(8分)某些化学反应可用下式表示
A + B ─→ C + D + H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:
。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A为Na2O2,B为硫酸,则C和D的化学式是 。
(4)若A为单质,B为第二周期某种元素的最高价氧化物的水化物,请写出符合上式的化学方程式:
。
26、有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH >7,乙溶液pH <7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图
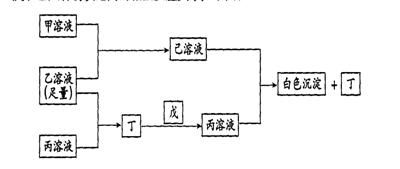
请回答
(1)写出C元素的原子结构示意图________ __,写出戊的电子式____ ______;
(2)用有关化学用语解释乙溶液呈酸性的原因______________________________;
丙溶液呈碱性的原因_____________________________;
(3)写出有关反应的离子方程式
①乙溶液+丙溶液→丁________________________________________________;
②己溶液+丙溶液→丁________________________________________________。
| 得分 | 评卷人 |
|
|
|
四、本题包括1小题,共13分
27、某芳香烃A有如下转化关系:
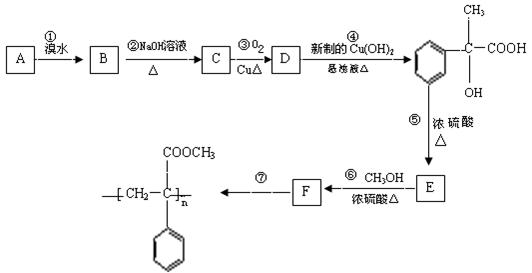
⑴.反应②和⑤的类型:②属于 反应;⑤属于 反应;
⑵.A、F结构简式:A ;F ;
⑶.反应③、⑥的化学方程式:
③ ;
⑥ ;
⑷.D还可以和新制的银氨溶液反应,化学反应方程式为:
。
| 得分 | 评卷人 |
|
|
|
五、本题包括1小题,共7分
28、在一定条件下发生反应
2SO2(g) + O2(g) ![]() 2SO3(g) ;△H <0
2SO3(g) ;△H <0
(1)500℃时,将a mol SO2与b mol O2以3﹕2通入固定容积为5L的密闭容器中,
①反应进行至10min时,测得n(SO2) = 8 mol,n(SO3) = 4 mol,
则b = mol。
②10min内平均速率![]() (SO2)= 。
(SO2)= 。
③反应达平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时SO2的转化率为
![]() 1(SO2)= 。
1(SO2)= 。
(2)当反应温度、起始SO2与O2物质的量均与(1)相同时,将其混合气通入一恒压反应容器中,达平衡时SO2的转化率![]() 2与(1)中转化率
2与(1)中转化率![]() 1的关系是
1的关系是
![]() 2
2 ![]() 1(填 =、 > 或 <)。
1(填 =、 > 或 <)。
高三化学参考答案
1 选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | B | B | C | B | D | C | C | D | A | C | B |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | D | D | C | D | A | C | B | D | C | D | A |
二、(每空2分)
23、(1)Ag+、Ba2+、Al3+、
(2)Na+、、、
(3)取沉淀少许滴入稀盐酸,若沉淀全部溶解则为碳酸钡,若部分溶解则为碳酸钙和硫酸钡
24、(1)A、B (2)A、E、F (3)A (4)G (5)C (6)D
三、25、(8分)(1)Cl2+2OH-=Cl-+ClO-+H2O (2分) (2)C、浓H2SO4 (2分)
(3)Na2SO4、O2 (2分)(4)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O (2分)
CO2↑+4NO2↑+2H2O (2分)
(或:Cu+4HNO3(浓)![]() Cu(NO3)2+2NO2↑+2H2O,
Cu(NO3)2+2NO2↑+2H2O,
3Cu+8HNO3(稀)![]() 3Cu(NO3)2+2NO↑+4H2O,其他合理答案也可)
3Cu(NO3)2+2NO↑+4H2O,其他合理答案也可)
26、(共10分)(1) 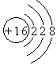 ,Na+[:
,Na+[:![]() :
:![]() :]2-Na+ (各1分)
:]2-Na+ (各1分)
(2)HSO4-= H++SO42-, CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
(3)①2H++CO32-= CO2↑+H2O;② 2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑
四、27、(13分)(1)取代(1分); 消去(1分) 。
(2)A: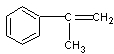 (1分) F:
(1分) F: 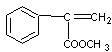 (1分)
(1分)
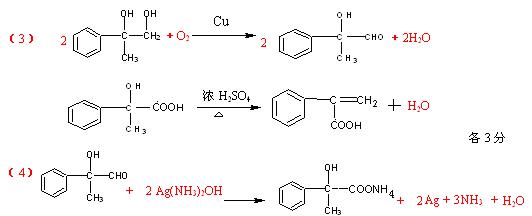
五、28(1)①8 (1分) ② 0.08 mol/(L· min) ③95%; (各2分)
(2)> (2分)