08届高三年级化学第二次诊断性考试试题
化 学
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间
90分钟。
2.不能使用计算器。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Fe—56 Cu—64
第Ⅰ卷(选择题 共44分)
一、选择题(本题包括18小题,1—10小题每小题2分,11—18小题每小题3分,共44分,每小题只有一个选项符合题意)
1.2008年夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指 ( )
A.把环境保护作为奥运设施规划和建设的首要条件
B.严禁使用兴奋剂,使运动员公平竞争
C.所有奥运用品全是绿色的
D.奥运场馆建设均使用天然材料,不使用合成材料
2.2007年10月24日,“嫦娥一号”开始了它的探月历程,它的一项重要任务是探测月球表面土壤里的一种非常有用的资源——可控核聚变的原料3He,3He是一种安全高效而又清洁无污染的物质,据统计,月球上的3He可以满足人类1万年以上的供电需求,月球土壤的3He含量可达500万吨。关于3He的叙述正确的是 ( )
A.3He和4He两种核素互为同素异形体
B.3He和4He两种核素互为同位素
C.核聚变时,原子核发生了变化,发生了化学反应
D.在3He中存在:质子数=中子数=核外电子数
3.下列叙述正确的是 ( )
A.由同种元素组成的物质肯定属于纯净物
B.一种元素可形成多种离子,但只能是带同种电荷的离子
C.含金属元素的离子不一定都是阳离子
D.具有相同质子数的粒子都属于同种元素
4.设NA为阿伏加德罗常数,下列说法不正确的是 ( )
A.18g水中含有的电子数为10NA
B.46g二氧化氮和46g四氧化二氮含有的原子数均为3NA
C.1L 1mol·L—1的盐酸溶液中,所含氯化氢分子数为NA
D.标准状况下,11.2L臭氧中含1.5NA个氧原子
5.氧化还原反应的实质是电子的转移,下列关于氧化还原反应的叙述正确的是 ( )
A.在氧化还原反应中,有一种元素被氧化,肯定有另一种元素被还原
B.11.2L Cl2通入足量的NaOH溶液中,转移的电子数为0.5NA
C.难失电子的原子,得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
6.下列各分子中,所有原子都满足最外层为8电子结构的是 ( )
A.H2O B.BF3 C.CCl4 D.PCl5
7.下列除去杂质的方法正确的是 ( )
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
8.下列离子能够大量共存的是 ( )
A.无色溶液中:Fe3+、Na+、NO3—、Cl—
B.pH=0的溶液中:Fe2+、NO3—、Cl—、HCO3—
C.含MnO4—的溶液中:Fe3+、SO42—、NO3—、Mg2+
D.与铝作用生成氢气的溶液:Mg2+、NO3—、K+、Cl—
9.下列离子方程式书写正确的是 ( )
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3—+OH—=CaCO3↓+H2O
B.钠与水的反应Na+2H2O=Na++2OH—+H2↑
C.铜片跟稀硝酸反应:Cu+NO3—+4H+
Cu2++NO↑+2H2O
D.铝片和氢氧化钠溶液反应:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
|
|
A.NH3、NO2、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
11.已知短周期元素的离子aA2+、bB+、cC3—、dD—都具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子半径A>B>D>C B.原子序数D>C>B>A
C.离子半径C>D>B>A D.单质的还原性A>B>D>C
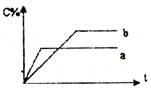
![]() 12.右图表示可逆反应A(s)+B(g) nC(g);△H=Q,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是
12.右图表示可逆反应A(s)+B(g) nC(g);△H=Q,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是
|
A.若条件为催化剂,则a表示有催化剂,b表示没
有催化剂
B.只控制温度,则a比b的温度高,△H>0
C.只控制压强,则a比b的压强大,n>2
D.由图象可以作出判断,反应一定从正反应方向开始
13.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是 ( )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的阴极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极反应为Cl2+2e—=2Cl—
14.在20mL 0.1mol·L—1KOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是 ( )
A.C(K+)=C(Ac—)+C(HAc)
B.C(K+)+C(H+)=C(Ac—)+C(OH—)
C.C(K+)>C(Ac—)>C(H+)>C(OH—)
D.C(K+)>C(Ac—)>C(OH—)>C(H+)
15.现将0.2molCH3COONa晶体和标况下2.24升HCl气体同时溶解于同一烧杯的水中,制得1L溶液,若此溶液中c(CH3COO—)>c(Cl—),则下列判断中不正确的是( )
A.pH小于7(298K)
B.c(CH3COOH)+c(CH3COO—)=0.20mol·L—1
C.c(CH3COOH)<c(CH3COO—)
D.c(CH3COO—)+c(OH—)=0.10mol·L—1
16.在2mol·L—1的硫酸和2mol·L—1的硝酸混合溶液10mL中,加入0.96g铜粉,充分反应后,最多可收集到标况下的气体的体积为 ( )
A.89.6mL B.112mL
C.168mL D.224mL
17.向一定量的Fe、FeO、Fe2O3的混合物中,加入200mL 1mol·L—1的盐酸恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,得到的铁的质量为 ( )
A.11.2g B.5.6g
C.2.8g D.22.4g
18.向盛有NaHSO4溶液的烧杯中不断滴加Ba(OH)2溶液,随着Ba(OH)2的不断滴入,溶液中产生的沉淀量与溶液的pH变化情况正确的是 ( )
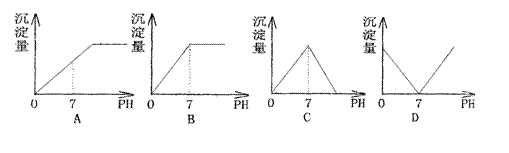 |
|
二、(本题包括2小题,共13分)
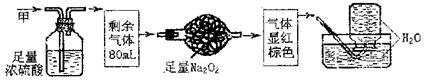
|
已知2NH3+3CuO N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是 稀硫酸的作用是 。
(2)浓氨水与固体NaOH接触,为什么会逸出大量氨气?
(3)证明NH3具有还原性的实验现象是
20.(7分)A、B、C、D均为中学化学所学的常见物质,且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其它产物已略去):
|
请填写下列空白:
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,则D为(填写化学式)
。
(2)若A为气体,其水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则工业上合成A的化学方程式为 。
(3)若A为短周期元素的形成的非金属单质,则A可能是
(填3种不同单质的化学式)。
三、(本题包括2小题,共18分)
21.(10分)将化学知识系统化,有助于对化学问题的进一步认识。请你参与下列关于化学
 反应的讨论。
反应的讨论。
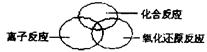
问题1:从不同的角度,化学反应可以有不同的
分类方法,不同类别的化学反应间又有一定的联
系,请在右图的方框中,用图示(每个圆圈代表
一类反应)的方法表示离子反应、化合反应和氧
化还原反应之间的关系。
问题2:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)
| 序号 | 实际生产中采取的措施 | 工业生产实例(各写1个化学方程式) |
| (1) | 通过增大压强提高原料转化率 | |
| (2) | 使用催化剂增大反应的速率 |
|
。
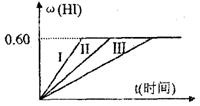
22.(8分)将2mol I2(g)和1mol H2置于某2L密闭容器中,在一定温度下发生反应:
|
(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件,在甲条件下ω(HI)的变化如图曲线(Ⅰ)所示,在乙条件下
ω(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
四、(本题包括2小题,共25分)
23.(8分)短周期中的六种元素A、B、C、X、Y、Z,原子序数依次减小,其中X、Y、Z
原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物;C与X处于同周期,B+与C2—的核外电子排布相同,A与B处于同周期,且形成BA型化合物。请回答:
(1)Y元素的名称是 ;
(2)XZ3的化合物的电子式是 ;
(3)A、B、C的离子半径由大到小的顺序为 (用元素离子符号表示)
(4)化合物XZ4A中所含的化学键类型为 ,该化合物水溶液可用于金属除锈,其原因是: (用离子方程式表示)
(5)元素组成的化合XZ5YC3和足量的化合物BCZ反应的离子方程式为
。
24.(17分)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想。
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是
;
。(请写两条)
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热学化方程式:H2(g)+1/2O2(g) H2O(l);△H=-285.8kJ/mol
C(g)+O2(g)=CO2(g);△H=-393.5kJ/mol
C8H18(l)+25/2O2(g) 8CO2(g)+9H2O(l);△H=-5518kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l);△H=890.3kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是 ,通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
(3)已知:H2(g)=H2(l);△H=-0.92kJ/mol O2(g)
O2(l);△H=-6.84kJ/mol
H2O(l)=H2O(g);△H=44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式: 。
如果此次嫦娥一号所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,总共释放能量 kJ(保留3位有效数字)。
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应式为:负极: ; 正极: ;
总反应式: 。
(5)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。(写出计算过程)
①若溶液体积仍为100mL,此时溶液的pH为多少?(不考虑硫酸铜水解)
②此时氢氧燃料电池中消耗H2和O2的质量各是多少?(保留2位小数)
参考答案
第Ⅰ卷(选择题,共44分)
1—5 ABCCD 6—10 CCCDB 11—15 CDBCD 16—18 DBA
|
19.(6分)(1)吸收水蒸气(1分);吸收氨气,防止污染(1分)
![]()
![]() (2)NaOH吸收溶液中水分放热,使溶液温度升高,有利于NH3·H2O分解(1分);氢氧根离子浓度增大,使NH3+H2O NH3·H2O NH4++OH—平衡左移,也有利于氨气的逸出(1分)
(2)NaOH吸收溶液中水分放热,使溶液温度升高,有利于NH3·H2O分解(1分);氢氧根离子浓度增大,使NH3+H2O NH3·H2O NH4++OH—平衡左移,也有利于氨气的逸出(1分)
|
![]() 20.(7分)(1)H2SO4(2分)(2)N2+3H2 2NH3(2分)
20.(7分)(1)H2SO4(2分)(2)N2+3H2 2NH3(2分)
(3)C、N、S(3分,每填对1个给1分)
|
问题1:
 |
问题2:(1)N2+3H2 2NH3 2SO2+O2 2SO3(其他合理答案也正确)
问题3:Cu+4H++2NO3—(浓)=Cu2++2NO2↑+2H2O
3Cu+8H++2NO3—(稀)=3Cu2++2NO↑+4H2O(其他合理答案也正确)
22.(8分,每空2分)
(1)0.55mol·L—1 (2)③⑤ ① (3)4b+c=2a
|
23.(8分)(1)碳(1分) (2)
(3)Cl—>O2—>Na+
![]() (4)离子键和极性共价键 (1分) NH4++H2O NH3·H2O+H+(2分)
(4)离子键和极性共价键 (1分) NH4++H2O NH3·H2O+H+(2分)
(5)NH4++HCO3—+2OH—=NH3·H2O+CO32—+H2O(2分)
24.(17分)(1)相同质量时,氢气放出的热量多(1分);产物为水,无污染(1分)
(2)H2(1分),4.4:1(1分)
(3)H2O(l)+1/2O2(l) H2O(g);△H=-237.46kJ/mol(2分)
5.94×108(2分)
(4)负极:2H2+4OH—-4e— 4H2O(1分)正极:O2+2H2O+4e— 4OH—(1分)
总反应式:2H2+O2 2H2O(1分)
(5)(①3分;②3分)
①阴极反应为:Cu2++2e—=Cu 2H++2e—=H2↑
当阴极收集到氢气0.112L时,铜已反应完全,共转移电子0.03mol,
此时阳极2Cl—-2e—=Cl2↑反应恰好完全。
溶液中剩余的[OH—]=0.1mol/L,溶液PH=13。
②设消耗H2和O2的质量分别为x、y。
2H2 + O2 2H2O ~ 4e—
4g 32g 4mol
x y 0.03mol
解得:x=0.03g y=0.24g
所以,消耗H2 0.03g;消耗O2 0.24g。