08届高三第三次月考化学试卷
时量:90min 满分:110分
命题:关中岩
可能用到的相对原子质量:I~127,C~12,N~14,O~16,Na~23,S~32,Cl~35.5
一、选择题(本题包括16个小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.生产、生活离不开各种化学物质,下列说法不正确的是( )。
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用单质硅制造光导纤维
2.下列说法正确的是( )。
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
3.成语包含了透彻完整的思想内容,寓意深刻,生动形象,简练明了,是我国古代历史文化的宝贵遗产。下列有关金属的成语中,与碱金属有关的是( )。
A.百炼成钢 B.火树银花 C.点石成金 D.沙里淘金
4.将SO2通到显红色的酚酞试液中,发现红色消失,主要是因为SO2具有( )。
A.漂白性 B.还原性 C.氧化性 D.溶于水后显酸性
5.下列递变规律正确的是( )。
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的还原性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
6.有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用,如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )。
A.34S原子核内的中子数为16
B.16O与 18O互称同位素
C.13C和15N原子核内的质子数相差2
D.2H+的酸性比1H+的酸性更强
7.用向硫酸酸化的碘化钾溶液里加入过氧化氢溶液,不久就有无色小气泡从溶液中逸出,且溶液呈棕黄色,有关叙述有:①向溶液里滴入淀粉溶液显蓝色;②逸出的气泡是HI;③离子方程式为:H2O2+2I-=I2+O2+2H+;④离子方程式为:H2O2+2I-+2H+=I2+2H2O;⑤反应时还有H2O2分解为水和O2,其正确的是( )。
A.①④⑤ B. ①②④ C.③④⑤ D.①③⑤
8.下列说法正确的是( )。
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
A.①②③ B.①④ C.②③④ D.③④
 9.右图是某学校实验室从化学试剂商店买回的硫酸试剂
9.右图是某学校实验室从化学试剂商店买回的硫酸试剂
标签上的部分内容。据此下列说法正确的是( )。
A.该硫酸的物质的量浓度为9.2mol/L
B.1molZn与足量的该硫酸反应产生2g氢气
C.配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度
大于9.2mol/L
10.下列叙述不正确的是( )。
A.氯水溶液通常保存在棕色试剂瓶中,是因为次氯酸见光易分解
B.将Cl2和SO2分别通入到品红溶液中,均能使品红溶液褪色
C.反应AgCl + NaBr=AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
11.下列关于某无色溶液中所含离子的鉴别,判断正确的是( )。
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
12.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Cl-、
Mg2+、Ba2+、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验:(1)第一份加入AgNO3溶液有白色沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol;(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )。
A.K+一定不存在,SO42-一定存在 B.100 mL溶液中含0.02mol CO32 -
C.Cl-一定不存在,CO32-一定存在 D.Ba2+一定不存在,Mg2+可能存在
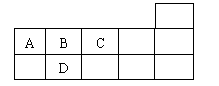 13.右表为元素周期表短周期的一部分,下列有关四种元素的叙述正确的是( )。
13.右表为元素周期表短周期的一部分,下列有关四种元素的叙述正确的是( )。
A.原子半径:A>B>C>D
B.氢化物稳定性:A>B>C>D
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下均不导电
14.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )。
A.X肯定为碱金属元素
B.稳定性:Y的氢化物>Z的氢化物
C.X、Y两元素形成的化合物一定为离子晶体
D.Y、Z两元素可以形成两种常见化合物
15.下列离子反应方程式不正确的是( )。
A.澄清石灰水来吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO![]() +H2O
+H2O
D.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
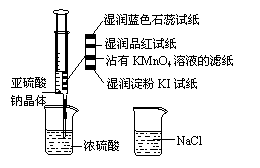 16.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )。
16.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )。
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸均褪色证 明了SO2漂白性
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaCl溶液可用于除去实验中多余的SO2
2008届高三第三次月考
化学答卷
一、选择题(本题包括16个小题,每小题3分,共48分。每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
二、非选择题(共62分)
17.(6分)已知X和Y均是短周期元素中的同主族元素的单质,W、V是化合物,它们有如下变化关系:X+W→Y+V
试写出符合题意,且满足下列关系的化学方程式:
(1)W是水 ;
(2)V是水 。
18.(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一元素。
|
(1)画出C的原子结构示意图 。
(2)画出B与E形成的化合物的电子式 。
(3)写出F与D的氢化物反应的离子方程式 。
(4)2.3g A与足量D的氢化物完全反应产生的气体在标准状况下的体积为
L。
(5)已知D的一种单质具有强的氧化性,能使碘化钾淀粉试纸变蓝,其方程式为
O3+2KI+H2O=O2+I2+2KOH,当生成1.27g碘时转移的电子数为 。
19.(10分)在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)。
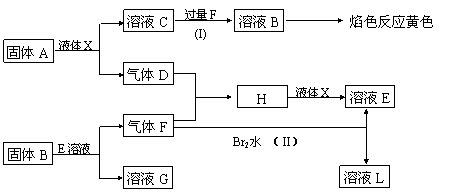 |
请回答:
(1)写出化学式A ,B ,G 。
(2)写出反应(I)的化学方程式 。
(3)写出反应(II)的离子方程式 。
 20.(10分)在实验室里可用右图所示装置
20.(10分)在实验室里可用右图所示装置
制取次氯酸钠和探究氯水的性质。
图中:
① 为氯气发生装置;
装置②的试管里盛有15 mL 8%的
NaOH溶液,并置于冰水浴中;
装置③的试管里加有紫色石蕊试液;
装置④为尾气吸收装置。
请填写下列空白:
⑴ 实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________________的净化装置。
⑵ 本实验中制取次氯酸钠的离子方程式是___________________________________。
⑶ 实验中可观察到③的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_____色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
⑷ 为了使新制氯水中HClO的浓度增加,可向其中加入适量________________。
A.NaOH B.CaO C.CaCO3(s) D.H2O
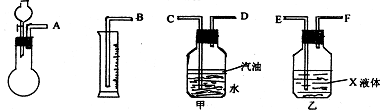
21.(16分)实验室有一瓶Na2SO3固体,可能含有NaCl、Na2SO4、KNO3、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3的质量分数。
称此样品6.30g,加入6.0mol/L的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色。请根据实验填写下列空白:
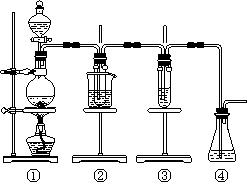
① 若用下图所示仪器组装进行上述实验,气流从左到右各仪器的正确连接顺序为(填编号字母)_______接 , 接 , 接 ,
液体X是 ,汽油的作用是 。
② 操作时,怎样才能正确地测出放出气体的体积
。
③ 若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是 。
一定含有的杂质是____________。
22. (10分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
![]() ②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为__________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
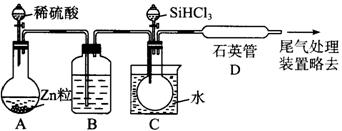
① 装置C中的烧瓶需要加热,其目的是____________________________________。
②反应一段时间后,装置D中观察到有固体生成,装置D中发生反应的化学方程式为 ___________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性、控制好反应温度以及______________________________________。
参考答案与评分标准
一、选择题(3×16=48分)
1.D 2.B 3.B 4.D 5.A 6.B 7.A 8.C 9.C 10.D 11.C 12.B 13.C 14.D 15.D 16.C
二、非选择题(共62分)
17.(每空3分,共6分)
(1)2Na+2H2O = 2NaOH + H2↑ (2)O2 + 2H2S = 2S↓+2H2O
18.(每空2分,本题共10分)
(1)略 (2)略 (3)Cl2+H2O=HClO+Cl一+H+
(4)1.12 (5)6.02×1021
19.(每空2分,本题共10分)
(1)Na2O2 NaHSO3 Na2SO4
(2)NaOH+SO2=NaHSO3
(3)SO2+Br2+2H2O=4H++SO42-+2Br一
20.(每空2分,本题共10分)
⑴ 饱和食盐水
⑵ Cl2+2OH-=ClO-+Cl一+H2O
⑶ 红 氯气与水反应生成的HClO将石蕊氧化为无色物质
⑷ C
21.(本题共16分)
① A;E;F;D;C;B(2分);浓硫酸;(2分)防止产生的气体溶于水(2分)
② 视线与量筒内液面持平;调整量筒高度,使甲瓶中液面与量筒液面在同一位置上。(4分)
③ 50%;(2分)NaCl、Na2SO4(4分)
![]() 22.(每空2分,本题共10分)
22.(每空2分,本题共10分)
(1)SiO2+2C Si+2CO↑
(2)蒸馏(或分馏)
(3)使滴入烧瓶中的SiHCl3气化
② SiHCl3+H2![]() Si+3HCl
Si+3HCl
③排尽装置中的空气