08届高三级化学模拟试卷
本试卷满分150分。考试用时120分钟。
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27
S32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1..患甲状腺肿大是边远山区常见的地方病,下列元素对该病有治疗作用的是( )C
A.钠元素 B.氯元素 C.碘元素 D.铁元素
2.下列物质中,既含有氯分子,又含有氯离子的是( )
A.氯化钠溶液 B.新制氯水 C.漂白粉 D.液氯
3.下列所用材料不属于合金的是( )
A.家用的铝窗 B.建筑用的钢筋
C.铸造用的黄铜 D.温度计用的水银
4.将足量的CO2通入下列溶液中,能产生沉淀的是( )A
A.硅酸钠溶液 B.石灰水 C.氯化钡溶液 D.氯化钙溶液
5.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO –>I2 > SO42– B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色 D. 次氯酸钠可以与亚硫酸钠共存
6.下列关于Na和Na+ 的叙述中,错误的是( )
A.具有相同的质子数 B. 它们的化学性质相似
C.钠离子是钠原子的氧化产物 D. 灼烧时火焰都呈黄色
7.下列离子反应方程式正确的是 ( )
A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
8.在一定的温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来的温度,下列说法正确的是( )
A.溶液中溶液中Na+浓度增大,有O2放出
B.溶液中OH-总数不变,有O2放出
C.溶液的pH增大,有O2放出
D.溶液中Na+总数减少,有O2放出
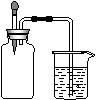 9.如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
9.如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
①CO、O2; ②Cl2、CH4; ③NO2、O2; ④N2、H2;
A.①② B.②④ C.③④ D.②③
10、下列气体中,既有颜色又有毒性的是( )
A.N2 B.CO C.Cl2 D.CO2
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
11.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸钠溶液中滴加稀硫酸 B.氯化铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.酸性高锰酸钾溶液中滴加亚硫酸钠溶液
12.常温下,下列溶液中一定能大量共存的离子组是
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
13.设NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.标准状况下,2.24 L苯中含有0.6NA个碳原子
B.常温常压下,46 g NO2和N2O4混合气体中含有原子数为3NA
C.25℃时,1 L pH=13的氢氧化钠溶液中含有No个氢氧根离子
D.0.01 mol铝与足量的氢氧化钠溶液反应转移的电子数是0.03 NA
14.化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是( )
A.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B.检验某溶液中是否含Cl – ,用HNO3酸化的AgNO3溶液
C.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化
D.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
15.下列各组物质中,仅用水及物质间相互反应就能区别的一组是 ( )
A.Na2O2 Al2(SO4)3 MgCl2 K2CO3
B.BaCl2 Na2SO4 CaCO3 KOH
C.AgNO3 NaCl KCl CuCl2
D.Fe2(SO4)3 K2CO3 KHSO4 BaCl2
16. 由Zn,Fe,Al,Mg四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物中一定含有的金属是C
A.Zn B.Fe C. Al D.Mg
17.向50mL18mol·L-1的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是( )
A.等于0.9mol B.大于0.45mol,小于0.9mol
C.等于0.45mol D.小于0.45mol
18. 某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
A.Al2O3 B.MgO C.SiO2 D.P2O5
19. 在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反应中,当有mg的Cl2被氧化时,被还原的Cl2有( )
KClO3+5KCl+3H2O的反应中,当有mg的Cl2被氧化时,被还原的Cl2有( )
A.6m/35.5mol B.5m/71mol C.3mg D.5mg
20.、将nmolK2SO3和mmolNa2S溶于水,用稀硫酸酸化后,若生成物分别是①SO2和S,
②S和H2S,③只有S。则n与m之比值从(Ⅰ)1:2,(Ⅱ)大于1:2,
(Ⅲ)小于1:2中选出符合上述情况的组合是
(A)(Ⅰ)(Ⅱ)(Ⅲ) (B)(Ⅱ)(Ⅲ)(Ⅰ)
(C)(Ⅲ)(Ⅱ)(Ⅰ) (D)(Ⅱ)(Ⅰ)(Ⅲ)
第Ⅱ卷 非选择题(共80分)
三、(本题包括3小题,共38分)
21.(10分)硫酸的性质有:A.高沸点;B.强酸性;C.吸水性;D.脱水性;E.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
(1)实验室制取氢气________________;
(2)实验室干燥氢气___________________;
(3)浓硫酸与金属铜的反应________________;
(4)实际生产中,浓硫酸可用钢瓶贮运_________;
(5)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。
22.(14分)实验室制取SO2的反应原理为:
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
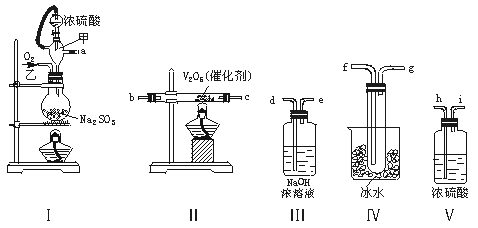
(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
23.(14分)下面是关于硫化氢的部分文献资料
资料:常温常压下,硫化氢(H2S)是一种无色气体,具有臭鸡蛋气味,饱和硫化氢溶液的物质的量浓度约为0.1mol·L-1。硫化氢剧毒,经粘膜吸收后危害中枢神经系统和呼吸系统,对心脏等多种器官造成损害。硫化氢的水溶液称氢硫酸(弱酸),长期存放会变浑浊。硫化氢及氢硫酸发生的反应主要有:
2H2S+O2=2H2O+2S↓ 2H2S+3O2=2H2O+2SO2
2H2S+SO2=2H2O+3S↓ 2H2S+Cl2=2HCl+S↓
H2S![]() H2+S↓
H2S+CuSO4=CuS↓+H2SO4
H2+S↓
H2S+CuSO4=CuS↓+H2SO4
H2S+2NaOH=Na2S+2H2O H2S+NaOH=NaHS+H2O
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
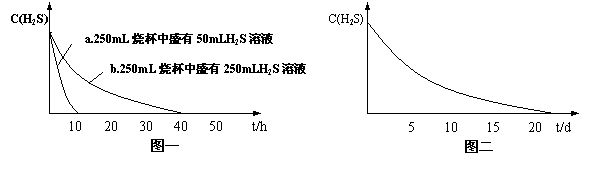
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
 实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
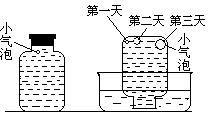
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为__________ 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应______
_______ 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____ __的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)________________ ______。此实验中通入空气的速度很慢的主要原因是什么?___________________ ____________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是____ _____。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?______________________ _______________。
四、(本题包括3小题,共28分)
24.((13分)下列A ~ I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去。已知A为固态单质,常温下C、E、F都是无色气体。
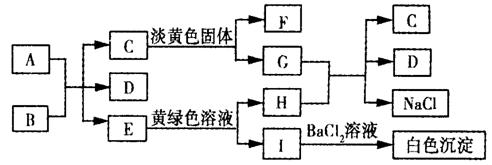
请填空:
(1)C的固体属于_____晶体,F的化学式(分子式)是________。
(2)A与B反应的化学方程式是:____ _____。
(3)G与H反应的离子方程式是____ ____,
E转变为H和I的离子方程式是_ _______。
25.(5分) 有X、Y、Z三种元素:
(a)X、Y、Z的单质在常温下均为气体;
(b)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
(c)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红;
(d)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
(e)Z单质溶于X2Y中,所得溶液具有漂白性。
(1)试写出其元素符号:X_______,Y_______, Z_______,以及化合物的分子式:
XZ_______,X2Y_________。
26.(10分)红矾(重铬酸钠Na2Cr2O7)是一种非常重要的工业产品;工业上生产红矾的工艺流程如下:
①铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2)与纯碱、石灰石混合后通过空气焙烧(使铬转化为+6价化合物)
②焙烧产物加水后,并用硫酸调成中性溶液
③过滤、滤液加硫酸酸化、浓缩、结晶成红矾
(1)完成下列化学方程式:
SiO2+CaCO3![]() ;
;
Al2O3+Na2CO3![]() 。
。
(2)配平下列反应方程式,填上系数:
FeO·Cr2O3+ Na2CO3+ O2 ¾ Na2CrO4+ Fe2O3+ CO2
(3)用水浸取焙烧产物,并用硫酸调成中性的目的是
并写出有关的离子方程式
五、(本题包括1小题,共14分)
27.(14分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
|
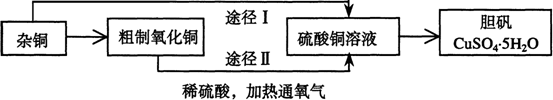
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在
上,不能直接放在桌面上。
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角
d 表面皿 e 坩埚钳 f 试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a 灼烧过程中部分氧化铜被还原 b 灼烧不充分铜未被完全氧化
c 氧化铜在加热过程中分解生成铜 d 该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 ___________次。
(6)若测定结果x值偏高,可能的原因是
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 胆矾晶体部分风化
 化学答题卷
化学答题卷
第Ⅱ卷 非选择题(共80分)
选择题(共70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 题号 |
|
|
|
|
|
|
|
|
|
|
三、(本题包括3小题,共38分)
21.(10分)(1)________________;(2)___________________;
(3)________________;(4)_________;(5)_______________。
22.(14分)
(1) → → → → → → → (填各接口的编号)。
(2) 。
(3) 。
(4) 。
(5) (填“增大”“不变”或“减小”)。
(6),SO2的转化率为 。
23.(14分)
(1)_________ 。
2)__________ 。
______ 。
(3)_____ __。
(4)(用文字说明)________________ ______。
___________________ ____________。
(5)___________________ ____________。
______________________ _______________。
24(13分)
1)_____晶体,F的化学式(分子式)是________。
(2)____ _____。
(3)____ ____,
_ _______。
25.。(5分)
(1):X_______, Y_______, Z_______, XZ_______, X2Y_________。
26.(10分)
1)
SiO2+CaCO3![]() ;
;
Al2O3+Na2CO3![]() 。
。
(2)
FeO·Cr2O3+ Na2CO3+ O2 ¾ Na2CrO4+ Fe2O3+ CO2
(3)目的是
有关的离子方程式
五、(本题包括1小题,共14分)
27(14分)
(1) , , 。
(2)
(3) 、 、
(4)两个优点是: 、
(5) ___________次。
(6)