08届高三化学第二次月考试卷
化 学 试 题
命题:赵家鹏 审校:李成刚
第Ⅰ卷(选择题共64分)
可能用到的相对原子质量:H—1,He—4,C—12,N—14,O—16,Na—23,Mg—24,
Al—27,Si—28,S—32,Cl—35.5,K—39,Ca—40,Fe—56,Cu—64,Br—80。
一、选择题:本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。
1、设阿伏加德罗常数为NA,则下列说法正确的是 ( )
A.12.0g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.a g O2和O3的混合气体中含有的分子总数为aNA/32
C.标准状况下,22.4 L H2S和SO2的混合气体中含有的分子总数为NA
D.常温常压下,28 g CO和N2的混合气体中含有的分子总数为NA
2、根据阿伏加德罗定律及其推论,下列说法正确的是 ( )
A.同温同压下,a g H2和b g He 的体积之比等于 a: 2b
B.同温同压下,a g NO和b g C2H6 的密度之比等于a:b
C.同温同体积下,a molO2和b mol O3的压强之比为2:3
D.平均相对分子质量为8.5的H2和N2混合气体中的分子数之比为3: 1
3、在20℃时,将10 g摩尔质量为M(A)(g/mol)的A物质投入90g 水中,刚好完全溶解,形成的溶液为饱和溶液(假设溶液的密度为1g/mL),则下列说法中正确的是 ( )
A.20℃时,A的溶解度一定是100/9g
B.20℃时,A的溶解度可能是10g
C.形成的饱和溶液的溶质质量分数一定为10%
D.形成的饱和溶液的物质的量浓度一定为100/M(A) mol/L
4、下列有关实验的现象描述正确的是 ( )
A.氢气在氯气中燃烧,火焰呈苍白色,产生大量白雾,剧烈放热。
B.硫在空气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体,剧烈放热。
C.铜在氯气中燃烧,产生白烟,加水溶解后可得绿色溶液。
D.用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰。
5、下列溶液中能用来区别SO2和CO2气体的是 ( )
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液
A.①④⑤⑥ B.②③④⑥ C.①②③⑥ D.②③④⑥
6、关于砷元素性质的说法不正确的是 ( )
A.砷很难与氢气发生化合反应 B.砷的含氧酸有H3AsO4和H3AsO3
C.砷的氢化物有AsH3和AsH5 D.砷的常见化合价有-3,+3,+5
7、将充有20mLN2和NO2的混合气体的试管,倒置在水槽中,反应完毕后,试管内残留气体为10mL,则原混合气体中N2和NO2的体积比是
A.1:1 B.1:2 C.1:3 D.2:3
8、实验室制取下列气体时,可选用同一套气体发生装置的一组是 ( )
A.H2和Cl2 B.NH3和NO2 C.NO和CO2 D.NH3和O2
二、选择题:(本题包括8小题,每小题4分,共32分。每小题有1—2个选项符合题意)
9、下列事实与胶体的知识有关的是 ( )
①用盐卤点豆腐。②水泥的硬化。③用明矾净水。④河海交汇出沙洲的形成。⑤土壤中施硝酸铵会使氮素流失。⑥用电泳法除去陶土中的氧化铁。⑦用石灰、纯碱法消除水的暂时硬度(除去水中的[Ca(HCO3)2和Mg(HCO3)2])。⑧一束光线通过浓雾时,从侧面观察到一条光亮的“通路”。⑨用FeCl3溶液对伤口止血比MgCl2的效果好。⑩将装有淀粉和NaCl溶液的半透膜袋置于盛水的烧杯中,一段时间后,向水中滴加碘酒,溶液未见变蓝。
A.①②④⑤⑥⑦⑧⑩ B.①②③④⑤⑥⑧⑨⑩
C.①②③④⑤⑦⑧⑩ D.①②③④⑤⑥⑦⑧⑨
10、把NaOH溶液和AlCl3溶液等体积混合后,沉淀物中铝元素的物质的量与溶液中铝元素的物质的量相等,则原NaOH溶液和AlCl3溶液的物质的量浓度之比是 ( )
A.2: 1 B.3: 2 C.4:1 D.7:2
11、已知X、Y两种元素可形成电子层结构相同的阴离子,Y的氢化物水溶液呈弱酸性,X的氢化物在常温下呈液态,Y的单质能从X的氢化物中置换出X,一定条件下2mol的Y单质也能和1mol的X的氢化物反应生成2mol的Y的氢化物和1 mol XY2,则XY2的化学式是 ( )
A.CO2 B.SCl2 C.OF2 D.NO2
12、硒与氧处于同一主族,与钾处于同一周期,则下列关于硒的说法中不正确的是( )
A.原子序数为24 B.最高价氧化物的分子式为: SeO2
C.非金属性比溴弱 D.气态氢化物的分子式为: H2Se
13、下列化学反应中都有水参加反应,其中水既不做氧化剂,又不做还原剂的是( )
A.Cl2+H2O=====HCl+HClO; B.CH4+2H2O=====CO2+4H2;
C.2Na2O2+2H2O====4NaOH+O2↑; D.2Na+2H2O=====2NaOH+H2↑;
14、CuCO3 和Cu2(OH)2CO3的混合物34.6 g ,可恰好完全溶解于300ml、2 mol.L-1的盐酸溶液中,加热分解等量的这种混合物可得CuO的质量 ( )
A.16.0 g B.19.2 g C.24.0 g D.30.6 g
15、下列离子方程式书写正确的是 ( )
A.二氧化硅和氢氧化钠溶液反应:SiO2+2OH-+H2O ===SiO32- + 2H2↑;
B.向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:Ca2++HCO3-+OH-===CaCO3↓+ H2O;
C.氯化铵和消石灰共热制取氨气:NH4++OH-=====NH3↑+ H2O;
D.将铝片投入到冷的浓硝酸中:Al+NO3-+4H+=====Al3++NO↑+ 2H2O;
16、在实验室里不宜长期放置,应该现用现配的溶液是 ( )①碘酒溶液,②硫酸亚铁溶液,③碳酸氢钠溶液,④氯水,⑤酸化的三氯化铁溶液,⑥硫化氢溶液
A.只有②④外 B.除①以外 C.只有②④⑥ D.全部
第Ⅱ卷(非选择题共56分)
三、(本题包括2小题,共20分)
17、(8分)碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者也大约有1000万人左右。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题。
(1)碘是合成下列哪种激素的主要元素之一 ( )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为_______________________,氧化产物与还原产物的物质的量之比为____________,能观察到的明显现象是_______________________ 。
18、(12分)X,Y,A,B,C,D是中学化学教材中常见的物质,且有图示的转化关系.气体C的式量比气体X的式量大2,D的焰色反应呈黄色,产物中水已忽略.
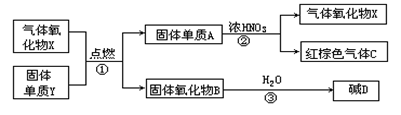
(1)写出有关物质的化学式:X Y A B C D
(2)反应①的反应类型是(填基本反应类型) .
(3)物质B的主要用途是 .
(4)反应② 的化学方程式为: .
四、(本题包括2小题,每格2分,共22分)
19、(8分)实验室现有下列药品:
固体药品:A、消石灰 B、氯化钠C、二氧化锰 D、氯酸钾 E、铜
液体药品:a、浓盐酸 b、过氧化氢c、饱和食盐水d、浓硫酸 e、浓硝酸 f、氯酸钾。
请选择合适的试剂制取下列气体:
(1)制取O2化学反应方程式是: 。
(2)制取Cl2化学反应方程式是: 。
(3)制取HCl化学反应方程式是: 。
(4)制取NO2化学反应方程式是: 。
20、(14分)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),
为确定其组成,化学兴趣小组的同学进行了如下实验:
(1)定性分析:(6分)
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
②请你设计一个简单的实验方案,确认样品中含有CO32—离子。
(2)定量分析:(8分)该小组同学设计了下图所示装置,测定天然碱的化学组成。
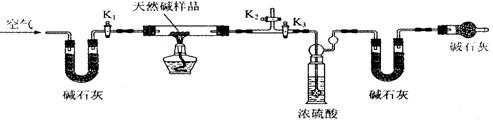
A B C D E
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 。
A处碱石灰的作用是 。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为 87.6g,装碱石灰的U型管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶质量为88.5g;装碱石灰的U型管D的质量为75.8g。该步骤中缓缓鼓入空气数分钟的目的是 。计算推导:该天然碱的化学式为 。
五、计算题:(本题包括2小题,共14分)
21、(6分)向100mL M(OH)2溶液中加入过量的NaHCO3溶液,生成金属M的碳酸盐沉淀。过滤后,将沉淀与足量的盐酸反应,生成4.48L标准状况下的气体;将滤液加水稀释到250mL,取出25.0mL恰好与20.0mL盐酸完全反应,收集到1.12L标准状况下的气体。
(1)写出M(OH)2溶液和NaHCO3溶液反应的化学方程式。
______________________________________________________________________。
(2)要计算金属M的原子量,你认为_______ ____(填序号)。
A、缺少M(OH)2溶液的物质的量浓度 B、缺少MCO3的质量
C、缺少与MCO3反应的盐酸的物质的量 D、题设条件已足够,不需要补充数据
22、(8分)向某FeBr2溶液中,通入1.12L标准状况下的氯气,完全反应后测得溶液中2c(Br-)=c(Cl-)=0.1mol/L,溶液体积变化和离子水解忽略不计,试求:
(1)原溶液的总体积是多少升?(2)原FeBr2的物质的量浓度多少?
08届高三化学第二次月考试卷
化学试题参考答案
第Ⅰ卷 (非选择题 共64分)
一、二项选择题答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | D | B | A | B | C | C | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | BD | C | AB | AC | C | B | C |
第Ⅱ卷 (非选择题 共56分)
三、(本题包括2小题,共20分)
17、(8分)(1)B (2)5KI+KIO3+6HCl===3I2+6KCl+3H2O; 5:1;溶液变蓝。
18、(12分)(1)化学式: X: CO2 Y: Na A: C
B: Na2O C: NO2 D: NaOH
(2)置换反应(3)制取过氧化钠(4)C+4HNO3====CO2↑+4NO2↑+2H2O;
四、(本题包括2小题,每格2分,共22分)↓↓↓
19、(1)2H2O2=====2H2O+O2↑;2KClO3====2KCl+3O2↑;
(2)MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O;
(3)2NaCl+H2SO4(浓)========Na2SO4+2HCl↑;
NaCl+H2SO4(浓)=========NaHSO4+2H2↑;
(4)Cu+4HNO3(浓)=====Cu(NO3)2+2NO2↑+2H2O;
(每空2分,共8分;条件不写扣1分,未配平,化学式错误不得分)
20、(14分)(1)定性分析:(6分)
①不能,因为NaHCO3受热分解也能产生水蒸气。
②取少量样品溶于水,滴加CaCl2(或BaCl2)溶液,有白色沉淀生成,说明有CO32-。
(2)定量分析:(8分)检查装置的气密性,除去空气中的CO2和H2O(g)。
将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收。
Na2CO3·2NaHCO3·H2O。
五、计算题:(本题包括2小题,共14分)
21、(6分)(1)M(OH)2+2NaHCO3=====M(OH)2↓+2H2O;(2)B。
22、(8分)n(Cl2)==0.05mol;(2分)4FeBr2+3Cl2===2FeCl3+2FeBr3+Br2;(2分)
V(aq)==0.05mol×2÷0.1mol/L==1L。(2分)
C(FeB2)==0.05mol×(4/3)÷1L==0.067mol/L。(2分)