08届高三化学第六次月考化学试卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ和答卷Ⅰ、Ⅱ,试卷共8页,有6大题25小题,满分为100分,考试时间100分钟。
2.本卷答案必须写在答卷Ⅰ、Ⅱ的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、学号、试场号、座位号分别填写在答卷Ⅰ、Ⅱ的相应位置上。考试结束后只需上交答卷Ⅰ、Ⅱ,考试时不能使用计算器。
4.本卷可能用到的相对原子质量:H—1,C—12,N—14,O—16,Na—23, Cl—35.5,Fe—56
第I卷(选择题 共40分)
一、选择题(每小题只有一个选项符合题意,共16分)
1.下列符合化学实验“绿色化学”的有
① 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
② 在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③ 实验室的废酸液或废碱液需要中和后再排放
A.①② B.①③ C.②③ D.①②③
2.下列反应中生成物总能量高于反应物总能量的是
A.乙醇燃烧 B.碳酸钙受热分解
C.铝粉与氧化铁粉末高温下反应 D.氧化钙溶于水
3.X、Y、Z三种非金属,原子最外层电子数相等,等物质的量的单质X2、Y2、Z2分别与足量钠反应时,反应热为△Hx2 > △Hy2 > △Hz2,下列判断一定正确的是
A.原子半径X < Y < Z
B.最高价氧化物对应的水化物的酸性可能为HZO4 < HYO4 < HXO4
C.气态氢化物的稳定性HX < HY < HZ
D.气态氢化物的沸点HX > HY > HZ
4.从宏观方面来说物质由元素组成,从微观方面来说物质由粒子构成。下列说法中不正确的是
A.![]() Fe与
Fe与![]() Fe互为同位素
Fe互为同位素
B.只由一种分子构成的物质一定为纯净物
C.质子数与电子数相同的某粒子,可能是一种分子或一种离子
D.46gNO2和46gN2O4含有的原子数相等
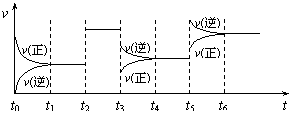 5.某密闭容器中发生如下反应:
5.某密闭容器中发生如下反应:
X(g)+3Y(g)![]() 2Z(g);ΔH<0右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
6.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
A.在水中所形成的分散系属悬浊液 B.“钴酞菁”分子既能透过滤纸也能透过半透膜
C.分子直径比Na+小 D.在水中形成的分散系能产生丁达尔效应
7.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH = 7时,下列关系正确的是
A.c(NH4+) = c(SO42-) B.c(NH4+) > c(SO42-)
C.c(NH4+) < c(SO42-) D.c(OH-)+c(SO42-) = c(H+)+c(NH4+)
8.下列说法错误的是
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
二、选择题(每小题只有一个选项符合题意,共24分)
9.表示下列变化的化学用语正确的是
A.NaHCO3的水解 HCO3-+H2 O ![]() H3O++CO32-
H3O++CO32-
B.金属铝溶于NaOH溶液 Al+2OH- =A1O2-+H2↑
C.钢铁吸氧腐蚀的正极反应 4OH- -4e-=O2↑+2H2O
D.1 L0. 5 mol·L-1稀硫酸与1 L 1 mol·L-1氢氧化钠溶液反应放出57. 3kJ的热量
H2SO4(aq)+2NaOH(aq) = Na2SO4(aq)+2H2O(1);△H=-114.6 kJ/mol
10.下列反应中由于氧化还原反应而引起溶液颜色变深的是
A.向FeCl3溶液中通入H2S气体 B.向Fe(NO3)2溶液中加入少许硝酸
C.向Fe(NO3)3溶液中加入硫氰化钾溶液 D.向Na2SO3溶液中加入溴水
11.用惰性电极做NaCl水溶液导电性实验时,下列叙述正确的是
A.通电时,只有Na+向阴极移动,Cl-向阳极移动
B.阳极发生了氧化反应,生成了氯气,阴极发生了还原反应,生成了还原产物氢气
C.若在阴极附近的溶液中滴入酚酞溶液,溶液无什么变化
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
12.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO![]() )、c(HCO3¯)都减少,其方法是
)、c(HCO3¯)都减少,其方法是
A.加入饱和石灰水溶液 B.加水
C.通入二氧化碳气体 D.加入氢氧化钠固体
13.在有乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是(说明:在实验过程中不允许采用加热、过滤、萃取等操作)
| 选项 | 试剂丙 | 甲离子 | 乙离子 |
| A | 稀盐酸、Ba(NO3)2溶液 | SO42- | SO32- |
| B | AgNO3溶液 | Cl- | I- |
| C | KSCN溶液 | Fe2+ | Fe3+ |
| D | 稀氨水 | Al3+ | Ag+ |
14.化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是
A.常温条件下,酚酞的变色范围:

B.分散系的分类:
![]()
C.HCl和NaAlO2溶液反应后铝元素的存在形式:
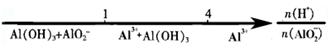
D.CO2通入澄清石灰水中反应的产物:
![]()
A.①② B.①③ C.②③ D.③④
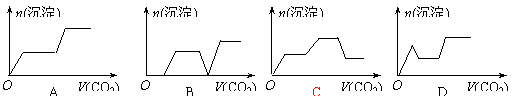 15.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
15.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
16.在120℃时,将质量均为m g的H2、CO、甲醛、甲酸甲酯完全燃烧,将生成的气体产物分别通过足量的固体过氧化钠干燥管,干燥管质量增加依次为:m1、、m2、m3、m4,则它们的关系正确的是:
A.m1 = m2 = m3 = m4 B.m1 > m2 > m3 > m4
C.m1 = m2 > m3 = m4 D.m1 < m2 < m3 < m4
第Ⅱ卷(非选择题 共60分)
三、(本题包括4小题,共29分)
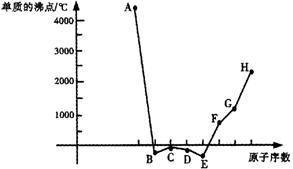
17.(8分)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如下图所示:
|
请回答:
(1)上述元素的最高价氧化物的水化物中,碱性最强的是(写化学式) ▲ ;上述元素的气态氢化物中,最稳定的是(写化学式) ▲ ;
(2)上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质的分子式是
▲ ;
(3)已知D、F、G三种元素的离子均具有跟Ne相同的电子层结构,则这三种离子的半径由大到小的次序为 ▲ > ▲ > ▲ (用相关元素的离子符号表示)。
18.(5分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- CO32- SO42- HSO4- |
分别取它们的水溶液进行实验。结果如下:
① A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
② A溶液与C溶液反应生白色沉淀,沉淀可溶于E溶液;
③ A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④ B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。据此推断它们是:
A__ ▲ ___、B__ ▲ ___、C__ ▲ ___、D__ ▲ ___、E__ ▲ ___。
19.(7分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑。若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是 ▲ (填编号);
A.CO2 + H2O + 2NaClO = Na2CO3 + 2HClO
B.CO2 + H2O + NaClO = NaHCO3 + HClO
C.CO2 + H2O + C6H5ONa → NaHCO3 + C6H5OH
D.CO2 + H2O + 2C6H5ONa → Na2CO3 + 2C6H5OH
E.Na2CO3 + C6H5OH → NaHCO3 + C6H5ONa
F.CH3COOH + NaCN = CH3COONa + HCN
(2)根据前述信息判断,浓度均为0.05mol/L的下列六种物质的溶液中,pH最小的是
▲ (填编号),其pH为 ▲ (填数值);pH最大的是 ▲ (填编号);
① C6H5OH ② CH3COOH ③ HCN ④ HClO ⑤ H2SO4 ⑥ HClO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
① 工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
② 工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体
③ 侯氏制碱法中,向碳酸氢铵饱和溶液中加入饱和食盐水可获得小苏打晶体
④ 蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一个规律 ▲ 。
将KI溶液与AgCl固体混合搅拌,固体变为黄色。该反应也遵循这一规律,请写出反应的化学方程式 ▲ 。
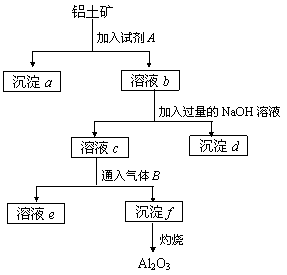 20.(9分)铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3。
20.(9分)铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3。
回答下列问题
(1)沉淀物的化学式分别是a ▲ 、d ▲ 、f ▲ ;
(2)溶液b中所含的金属阳离子是 ▲ ;溶液c中所含的酸根阴离子是 ▲ 。
(3)加入的试剂A是 ▲ ,通入的气体B是 ▲ ,能否将B换成A?
▲ ,其理由是 ▲ 。
四、(本题包括2小题,共13分)
21.(6分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
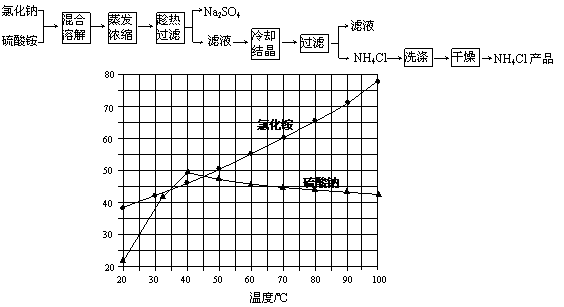 |
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需 NaCl ▲ g;
(2)实验室进行蒸发浓缩用到的主要仪器有 ▲ 、烧杯、玻璃棒、酒精灯等;
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 ▲ ;
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 ▲ ;
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 ▲ 。
22.(7分)某课外活动小组为了证明并观察铜与稀硝酸反应产物是NO,设计如图所示的实验装置,请你根据他们的思路,选择下列药品完成实验,并叙述实验步骤。
药品:稀硝酸、稀盐酸、锌粒、石灰石。
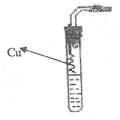 实验步骤:
实验步骤:
① 检验装置的气密性 ② 向试管中加入一定量固体CaCO3;
③ 向试管中倒入过量稀硝酸,并迅速塞紧带铜丝和导管的橡皮塞;
④ 反应完全后,将导管插入试管内并接近液面;
⑤ 将铜丝插入试管液面下与稀硝酸反应;
⑥ 用注射器向试管内推入空气(氧气)。试回答以下问题:
(1)步骤②③制取CO2的目的是 ▲ ;
(2)步骤④中“将导管插入试管内并接近液面”的目的 ▲ ;
(3)用注射器向试管内推入空气(氧气)的目的是 ▲ ;
(4)步骤④中还有一个缺陷,应作如何改进? ▲ ;
(5)分别将等质量的铜片与等体积过量的浓、稀硝酸反应,所得的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是铜离子浓度差异引起的.你同意这种看法吗?
▲ (填“同意”或“不同意”),原因是 ▲ 。另一同学提出溶液
呈“绿色”是Cu2+与NO2混合的结果,请设计一个实验证明之。 ▲ 。
五、(本题包括1小题,共6分)
23.(6分)已知两个羟基同时连在同一个碳原子上的结构是不稳定的,它要发生脱水反应:
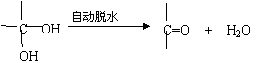
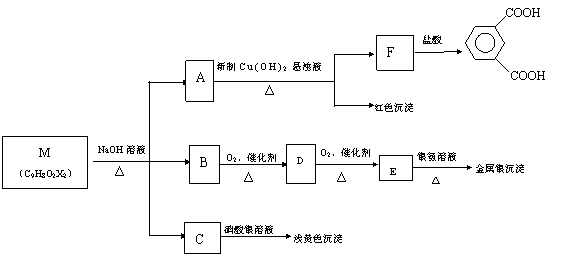 现有分子式为C9H8O2X2(X为一未知元素)的有机物M,可在一定条件下发生下图所示的一系列反应:
现有分子式为C9H8O2X2(X为一未知元素)的有机物M,可在一定条件下发生下图所示的一系列反应:
试回答下列问题:
(1)X为 ▲ (填元素符号);
(2)上述转化中其中属于氧化反应的共有 ▲ 步(填数字);
(3)M的结构简式为 ▲ ;
(4)写出A![]() F的化学方程式 ▲
。
F的化学方程式 ▲
。
六、(本题包括2小题,共12分)
24.(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为 ▲ ;
(2)所得溶液中Cl-的物质的量为 ▲ mol;
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2) = ▲ 。
25.(6分)2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL0.2mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原。计算原硝酸溶液的物质的量浓度。
高三第六次月考化学评分标准
第I卷(选择题 共40分)
一、选择题(每小题只有一个选项符合题意,共16分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | B | C | C | A | D | B | A |
二、选择题(每小题只有一个选项符合题意,共24分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | B | B | A | D | C | C | A |
第Ⅱ卷(非选择题 共60分)
三、(本题包括4小题,共29分)
17.(8分)(1)NaOH(2分) HF(2分)
(2)N2、O2、F2、Ne(2分,只写对一个不给分,写出两个给1分,写错没有分)
(3)F->Na+>Mg2+(2分)
18.(5分)A:Na2CO3、B:A12(SO4)3、C:MgCl2、D:Ba(OH)2、E:NaHSO4[或Mg(HSO4)2]
19.(7分)(1)A D(选对一个得1分,共2分,多选倒扣分)
(2)⑤;1;①(各1分,共3分)
(3)复分解反应能够向生成更难溶物质的方向进行(1分);KI+AgCl=AgI+KCl(1分)
20.(9分)(1)SiO2、Fe(OH)3、Al(OH)3 (3分)
(2)Fe3+ Al3+,(1分) AlO2-(1分)
(3)稀HCl, CO2, 不行, Al(OH)3是两性氢氧化物能溶于强酸。(各1分)
四、(本题包括2小题,共13分)
21.(6分)(1)11.7(1分) (2)蒸发皿(1分) (3)35℃(1分,33~40℃均可得分)
(4)加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净。(2分) (5)重结晶(1分)
22.(7分)(1)排尽试管内空气,防止NO与O2反应;(1分)(2)减少NO的逸出;(1分)
(3)证明无色气体是NO;(1分)(4)导管末端应连接一个尾气吸收装置;(1分)
(5)不同意(1分),Cu2+浓度是相同的,(1分)
只要对绿色溶液加热,若有红棕色气体逸出且溶液变蓝(或其他合理答案)。(1分)
![]() 五、(本题包括1小题,共6分)
五、(本题包括1小题,共6分)
23.(6分) (1)Br (1分) (2)4(1分) (3) (2分)
![]()
![]() (4)
+2Cu(OH)2
(4)
+2Cu(OH)2![]() +Cu2O↓+2H2O (2分)
+Cu2O↓+2H2O (2分)
六、(本题包括2小题,共12分)
24.(6分)(1)10.7% (2分) (2)0.25 (2分) (3)3︰2 (2分)
25.(6分) n[Fe(NO3)3]=n(I-)=0.100L×0.2mol/L=0.020mol (1分)
n[Fe(NO3)2]=n(Fe)-n[Fe(NO3)3]=![]() -0.020mol=0.030mol (1分)
-0.020mol=0.030mol (1分)
根据电子守衡:n[Fe(NO3)3]×3+ n[Fe(NO3)2]×2=n(NO)×3 (1分)
0.020mol×3+0.030mol×2= n(NO)×3 n(NO)=0.040mol(1分)
根据氮元素守衡:n(HNO3) = n(NO)+ n[Fe(NO3)3]×3+ n[Fe(NO3)2]×2
= 0.040mol+0.020mol×3+0.030mol×2 = 0.16mol (1分)
c(HNO3)=![]() (1分)
(1分)