08届高三化学第四次月考试卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ和答卷Ⅰ、Ⅱ,试卷共8页,有6大题25小题,满分为100分,考试时间100分钟。
2.本卷答案必须写在答卷Ⅰ、Ⅱ的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、学号、试场号、座位号分别填写在答卷Ⅰ、Ⅱ的相应位置上。考试结束后只需上交答卷Ⅰ、Ⅱ,考试时不能使用计算器。
4.本卷可能用到的相对原子质量:H—1,C—12,O—16, S-32,Cl—35.5
第I卷(选择题 共40分)
一、选择题(每小题只有一个选项符合题意,共16分)
1.化学与生活是紧密相联的,下列关于生活化学的说法正确的是
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,它们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
2.对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
A.化学反应速率变化时,化学平衡一定发生移动
B.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
C.正反应进行的程度大,正反应速率一定大
D.化学平衡发生移动时,化学反应速率一定变化
3.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3∶4。E原子从内到外各电子层的电子数之比为1∶4∶1。则下列叙述正确的是
A.由A和C形成的一种化合物能与E的单质在一定条件下发生置换反应
B.由A、C原子和B、D原子分别构成的分子电子数相等
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
4.铜板上铁铆钉处的吸氧腐蚀原理如右图所示,下列有关说法中,不正确的是
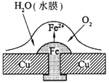 A.正极电极反应式为:2H++2e—→H2↑
A.正极电极反应式为:2H++2e—→H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
5.下列对化学知识概括合理的是
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.氧化物不可能是还原产物,只可能是氧化产物
C.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
D.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
6.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
7.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
8. 在一定条件下发生反应:3A(g) +
2B(g)![]() xC(g) + 2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率
xC(g) + 2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率
vB = 0.2 mol · L – 1 · min – 1,则下列说法正确的是
A.x = 3 B.B的转化率为20%
C.平衡时气体压强是原来的0.94倍 D.达到平衡时A的浓度为1.4 mol · L – 1
二、选择题(每小题只有一个选项符合题意,共24分)
9.已知下列热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = -24.8kJ/mol
Fe2O3(s)+![]() CO(g) =
CO(g) = ![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g)
△H
= -15.73kJ/mol
CO2(g)
△H
= -15.73kJ/mol
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H = +640.4kJ/mol
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H 约为
A.-218kJ/mol B.-109kJ/mol C.+218kJ/mol D.+109kJ/mol
10.为了证实CH3COOH是弱酸,下列实验方法错误的是
A.用醋酸做导电性实验时, 灯泡很暗
B.等体积pH=5的稀盐酸和醋酸分别与NaOH溶液完全反应,醋酸消耗NaOH溶液多
C.把等体积等浓度的醋酸溶液和稀盐酸稀释1000倍,醋酸比稀盐酸的pH变化小
D.测定CH3COONa溶液的pH > 7
11.下列说法中,不正确的是
A.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-) > c(NH4+)) > c(Cu2+) > c(H+) > c(OH-)
B.在0.1mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C.在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
12.下列离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2+ + 2OH-+ NH4+ +H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
B.澄清石灰水与稀盐酸反应Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C.在NaOH溶液中通人少量的SO2气体:SO2 + OH— =![]()
D.碳酸钡中加入稀硫酸:BaCO3 + 2H+ = Ba2+ + CO2↑+ H2O
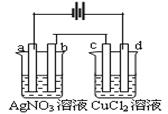 13.如右图,以惰性电极材料为电极进行电解,在a、b、c、
13.如右图,以惰性电极材料为电极进行电解,在a、b、c、
d各电极上析出生成物的物质的量比例关系正确的是
A.1∶1∶1∶1 B.2∶2∶1∶1
C.2∶2∶4∶1 D.4∶1∶2∶2
14.用等物质的量浓度的苛性钠溶液分别中和等体积的pH为2和3的醋酸溶液,设恰好中和时消耗苛性钠溶液的体积分别为Va和Vb,则Va和Vb的关系正确的是
A.Vb<10Va B.Vb=10Va C.Va>10Vb D.Vb>10Va
15.下列各组离子能在指定溶液中共存的是
① 无色溶液中:K+、Cl-、Na+、H2PO4-、PO43-、SO42-
② 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32-
③ 水电离的C(H+)=10-12mol/L的溶液中:ClO-、HCO3-、NO3-、NH4+、S2O32-
④ 加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤ 使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥ pH=0的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
A.①③ B.③⑥ C.①②⑤ D.②④⑤
16.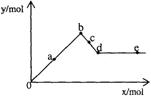 已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3
溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3
溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+不可能等于OH-
第Ⅱ卷(非选择题 共60分)
三、(本题包括4小题,共28分)
17.(8分)(1)请将4种物质:N2O、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
FeSO4 + ▲____ → ▲____ + ▲____ + ▲____ + H2O;
(2)反应物中发生氧化反应的物质是 ▲____,被还原的元素是 ▲____;
(3)反应中1 mol还原剂 ▲____(填“得到”或“失去”) ▲____mol电子;
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
| |
| |
18.(6分)已知:①短周期元素A、B、C、D的原子序数依次增大。②A、B、D的单质都能在C的单质中燃烧,分别生成化合物X、Y、Z。③X分别与Y、Z反应生成化合物E、F。④单质D也能在化合物Y中燃烧生成B的单质和化合物Z。⑤单质D还能与热的化合物X反应生成A的单质和化合物F。请回答下列问题:
(1)写出A的元素符号 ▲____;(2)写出D的原子结构示意图 ▲____;
(3)写出④中反应的化学方程式 ▲____;⑤中反应的化学方程式 ▲____。
19.(6分)在一个温度恒定的密闭容器中,SO2和O![]() 发生反应。已知1mol SO2和足量O
发生反应。已知1mol SO2和足量O![]() 完全反应,放出的热量为Q。请按要求回答下列问题。
完全反应,放出的热量为Q。请按要求回答下列问题。
【恒压条件下】
(1)若开始时放入1mol SO2和0.5mol O2,达平衡后,生成0.9mol SO3,这时SO2的转化率为 ▲____;
(2)若开始时放入4 mol SO2和2mol O2,,达平衡后,生成SO3的物质的量为 ▲____,反应放出的热量为 ▲____。
【恒容条件下】
(3)若开始时放入1 mol SO2和0.5mol O2,,达平衡后,生成a mol SO3,则a ▲___0.9(填“>”、“<”或“=”);
(4)若令x、y和z分别代表初始加入SO2、O2,和SO3的物质的量,要使达平衡时,反应混合物中三种气体的物质量分数与(3)中平衡时完全相同,则x、y、z必须满足的一般条件是 ▲____、 ▲____。(用两个代数式表示,其中一个只含x、y,另一个含x、z)
20.(8分)在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如右图所示,
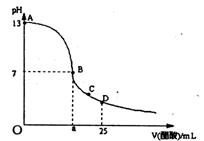 (1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式
▲____ ;
(2)该氢氧化钠溶液的物质的量浓度为 ▲____
mol·L—1;
(3)在B点,a ▲____12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中性,则混合前c(NaOH) ▲____c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:c(H+) ▲____c(OH-)。
(4)在D点溶液中离子浓度大小关系为 ▲____ 。
四、(本题包括2小题,共14分)
21.(4分)下列有关实验的叙述,不正确的是(填序号) ▲ 。
A.配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶
B.用渗析法分离淀粉中混有的NaCl杂质
C.无法用分液漏斗将甘油和水的混合液体分离
D.用酸式滴定管量取20.00mL高锰酸钾溶液
E.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F.在C2H5Cl与NaOH溶液共热的混合物中,加入AgNO3溶液即可检验氯元素
G.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
H.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
I.在氢氧化铁胶体中加入少量硫酸会产生沉淀
J.用结晶法可以除去硝酸钾中混有的少量氯化钠
22.(10分)在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为棕黄色。
(1) 甲同学认为是Br2溶于水变成棕黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成棕黄色。
(2)现提供试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断 ▲____(填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
(3)① 若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或“不可行”): ▲____理由是 ▲__ __;
② 向稀溴化亚铁溶液中通入过量氯气的离子反应方程式 ▲__ 。
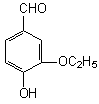 五、(本题包括1小题,共6分)
五、(本题包括1小题,共6分)
23.(6分)乙基香草醛(结构如右图)是食品添加剂的增香原料,其香
味比香草醛更加浓郁。
(1)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
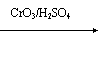
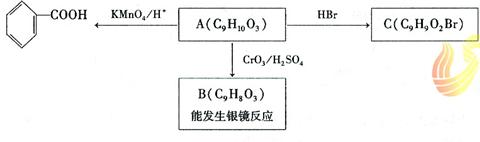
提示:① RCH2OH RCHO
② 与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基
(a)由A→C的反应属于 ▲__ (填反应类型),
 (b)写出A的结构简式 ▲__ ;
(b)写出A的结构简式 ▲__ ;
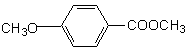
(2)乙基香草醛的一种同分异构体D( )是一种
医药中间体。请设计合理方案用茴香醛( )合成D
(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
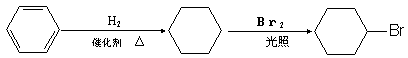 |
例如:
▲ 。
六、(本题包括2小题,共12分)
24.(6分)《环境空气质量标准》中,有害气体的浓度常用标准状况下,每立方米气体中含有害气体的毫克值(mg/m3)来表示,对CO的浓度限值规定为:
一、二级标准:4.00,三级标准:6.00 。一环保检测中心对采集的0.02m3(标况)某区域空气样品中所含CO的浓度进行测定,其方法和实验步骤如下:
① 首先将空气样品通过盛有I2O5固体的加热管,反应生成CO2和I2(不考虑其他气体的反应);
② 用30.0mL 5.00×10-5mol·L-1过量的硫代硫酸钠溶液完全吸收反应所产生的碘,
发生的反应为:I2+2S2O32-=2I-+S4O62-;
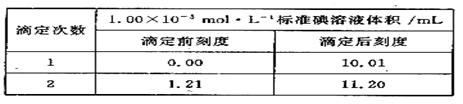 ③ 将②反应后溶液取出1/2,放入锥形瓶中,加入几滴指示剂,用1.00×10-5mol·L-1的标准碘溶液进行滴定,滴定至终点,实验记录如下:
③ 将②反应后溶液取出1/2,放入锥形瓶中,加入几滴指示剂,用1.00×10-5mol·L-1的标准碘溶液进行滴定,滴定至终点,实验记录如下:
(1)写出①中反应的化学方程式 ▲ ;
(2)计算该空气样品中CO的浓度,并说明符合几级标准。
25.(6分)把密度为1.68g / cm3的液态S2Cl2 10 mL 溶于石油醚(一种溶剂),得到100mL溶液,把它慢慢加入50 mL3.2mol/L的SO2 水溶液中,振荡使之充分反应,当加入的S2Cl2 溶液为64.3mL时,恰好反应完全。生成物用含0.32mol KOH的KOH溶液中和后,恰好完全转化为KCl 和一种二元含氧酸的钾盐晶体。试通过计算确定S2Cl2 与SO2 在溶液中反应的化学方程式。
高三第四次月考化学评分标准
第I卷(选择题 共40分)
一、选择题(每小题只有一个选项符合题意,共16分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | A | A | C | C | B | D |
二、选择题(每小题只有一个选项符合题意,共24分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | A | C | A | D | C | D | B |
第Ⅱ卷(非选择题 共60分)
三、(本题包括4小题,共28分)
17.(8分)(1)(2分)FeSO4+HNO3→Fe(NO3)3+Fe2(SO4)3+N2O+H2O
(2)(2分)FeSO4 +5价的N (3)(2分) 失去 1
(4)(2分)24FeSO4 + 30HNO3→
18.(6分)(1)H (2)![]() (3)2Mg+CO2
(3)2Mg+CO2![]()
Mg+2H2O![]()
19.(6分)(1)90% (2)3.6 mol 3.6Q (3)<
(4)x=2y x+z=1(以上各题答案合理均给分)
20.(8分)(1)CH3COOH +OH-=CH3COO-+H2O (2分) (2)0.1 (1分)
(3)大于,小于,小于(3分)(4)c (CH3COO- ) >c (Na+) > c (H+)> c (OH – )(2分)
四、(本题包括2小题,共14分)
21.(4分)A、E、F、H
22.(10分)(2) 乙 (2分)
| 选用试剂 | 实验现象 | |
| 第一种方法 | C (1分) | 有机层无色 (1分) |
| 第二种方法 | D (1分) | 溶液变红 (1分) |
(3)① 不可行(1分),因为Br2和Fe3+都能把I— 氧化成I2 (1分)
② 2 Fe2+ + 4 Br- + 3Cl2 == 2 Fe3+ +2 Br2 + 6Cl- (2分)
![]() 五、(本题包括1小题,共6分)
五、(本题包括1小题,共6分)
23.(6分) (1)(a)取代反应 (b)
![]() (2)
(2)
六、(本题包括2小题,共12分)
24.(6分)(1)5CO + I2O5![]() 5CO2+I2 (2分)
5CO2+I2 (2分)
(2)3.85mg/m3 ,符合一、二级标准 (4分)
25.(6分) 参加反应的S2Cl2 的物质的量:
n(S2Cl2)=
1.68g/cm3 ×10mL×![]() ÷135g/mol = 0.08mol(1分)
÷135g/mol = 0.08mol(1分)
参加反应的SO2 的物质的量n(SO2 ) = 50mL ×10-3L/mL ×3.2mol = 0.16 mol(1分)
生成HCl 的物质的量n(HCl) = 2 n(S2Cl2 ) = 2×0.08mol = 0.16mol(1分)
生成二元酸的物质的量n(二元酸) =(0.32 mol– 0.16mol)/2 = 0.08mol(1分)
故反应中n(S2Cl2) ∶n(SO2) ∶n(HCl) ∶n(二元酸)= 0.08∶0.16∶0.16∶0.08
= 1∶2∶2∶1 (1分)
所以化学方程式为:S2Cl2 +2SO2 +2H2O =2HCl + H2S4O6 (1分)