08届高三年级化学上学期月考试题
化 学
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.满分100分,考试时间90分钟。
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Cl:35.5
第Ⅰ卷(选择题 共54分)
一、选择题(本卷共18小题,每题3分,共54分。在下列各题的四个选项中,只有一个选项是符合题目要求的。)
1.环境污染已成为人类社会面临的重大威胁,下列对应关系不正确的是
| 环境问题 | 造成环境问题的主要物质 | |
| A | 酸雨 | 二氧化硫 |
| B | 温室效应 | 二氧化碳 |
| C | 白色污染 | 二氧化硅 |
| D | 光化学烟雾 | 二氧化氮 |
2.判断下列有关化学基本概念的依据正确的是
A.氧化还原反应:元素化合价是否变化
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.金属晶体:晶体是否能够导电
3。NA表示阿伏加德罗常数,下列说法正确的是
A.6.4g铜与足量的硫粉充分反应,转移电子数为0.2NA
B.0.1molNa2O2与足量的水反应转移电子数为0.2NA
C.标准状态下,22.4L的NH3和CH4的混合气体所含的电子数为10NA D.1molNH4+含有的共价键数为3NA
4.下列混合溶液中,各离子浓度的大小顺序正确的是
A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10mL0.1mol/L NH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
5. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应为:
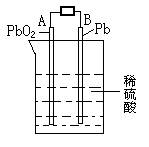 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O
2PbSO4+2H2O
则下列说法正确的是:
A.充电时:阳极反应是4OH--4e-=O2↑+2H2O
B.放电时:正极反应是Pb-2e-+SO42-![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.放电时:电子流动方向由B到A
6.下列离子方程式中正确的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
B.NH4HCO3 溶液与过量NaOH溶液反应:NH4++OH- = NH3↑+H2O
C.次氯酸钙溶液中通入少量二氧化碳:2ClO-+CO2+H2O = 2HClO+CO32-
D. FeBr2 溶液中通入过量Cl2:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl-
7.第三周期元素X,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物化学式一定为H2X
C.X元素在常温下稳定存在的氧化物一定能与烧碱反应
D.X的单质一定是良好的半导体材料
8.PH=3的两种酸溶液A、B,分别与足量的锌反应,酸A比酸B产生的氢气的量多,下列关于A、B酸性强弱判断正确的是( )
A.A的酸性>B的酸性 B. A的酸性<B的酸性
C. A的酸性与B的酸性一样强 D.无法判断A、B酸性的相对强弱
9.已知可逆反应2NO2(g)![]() N2O4(g);△H<0,在一定条件下,反应达到平衡后,再采取以下改变,再次达到平衡后,容器中气体颜色加深的是( )
N2O4(g);△H<0,在一定条件下,反应达到平衡后,再采取以下改变,再次达到平衡后,容器中气体颜色加深的是( )
①减小容器体积 ②升高温度 ③定容下充入气体N2O4 ④定压下充入NO2气体
A.①②③④ B.①②③ C.①② D.①③
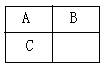 10.A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物x和y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )
10.A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物x和y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )
① B与C均存在同素异形体 ②x的种类比y的多
③常温下,B氢化物中无H+
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D .①④
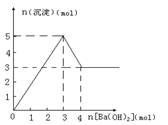 11.下图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量变化关系。该溶液的成分可能
11.下图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量变化关系。该溶液的成分可能
A.MgSO4 B.KAl(SO4)2
C.Al2(SO4)3 D.NaAlO2
12.下列各组离子,指定的条件下能大量共存的是
A.滴加甲基橙试剂呈红色的溶液:Fe2+、SiO32-、C1-、NO3-
B.水电离出来的C(OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
C.所含溶质为C(OH-)=10-13mol/L的溶液:K+、C1-、NO3-、A1O![]()
D.PH=11的溶液:S2-、SO![]() 、SO
、SO![]() 、Na+
、Na+
![]() 13.用来表示可逆反应:2A(g)+B(g) 2C(g)(正反应为吸热反应)的正确图像是
13.用来表示可逆反应:2A(g)+B(g) 2C(g)(正反应为吸热反应)的正确图像是
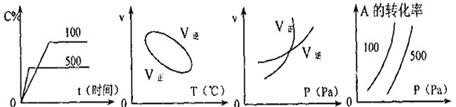
A. B. C. D.
14.下列说法正确的是
A.在浓硫酸与金属铜、木炭两个反应中浓硫酸既表现酸性又表现氧化性
B.区别浓硫酸和稀硫酸的方法可以用玻璃棒各蘸少许分别滴在纸上观察现象
C.常温下,浓硫酸可用铁或铝制容器储存,说明浓硫酸不与铁、铝反应
D.6.4g铜与足量的浓硫酸完全反应,生成2.24L的气体
15.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)=2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=b kJ/mol
16. 已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3Cl2+6FeI2=2FeCl3+4FeI3 B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2Fe3++2I- =2Fe2++I2
17.用下列实验装置完成对应的实验,操作正确并能达到实验目的的是
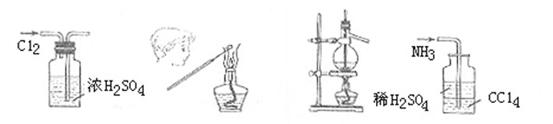 |
A.干燥Cl2 B.检验K2CO3中的K+
A B C D
A.干燥Cl2 B.检验K2CO3中的K+ C.石油的蒸馏 D.吸收NH3
18.下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
第Ⅱ卷(非选择题 共46分 )
19.(本题共11分)A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1) B的原子结构示意图______________;
(2)B、C、E与A形成的化合物中最稳定的 (写化学式);
(3)C与D形成的化合物的化学式是_________,它的性质决定了它在物质的分类中应属于____________;请写出该化合物的水化物的电离方程式 ;
(4)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式为 ;.
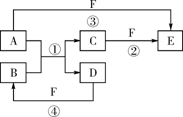 20.(12分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
20.(12分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,
且A、D所含元素同主族,
A、F所含元素同周期,
则反应①的化学方程式是______________________________________。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是______________________。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是_________________,
反应③的化学方程式是_________________________________。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构式是_____________,反应④的化学方程式是________________________________。
21.(本题共12分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁:
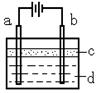 (1)a极材料为
,
(1)a极材料为
,
电极反应式为 。
(2)电解液d可以是 ,
则白色沉淀在电极上生成;电解液d也可以是 ,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是 ,在加苯之前对d溶液进行加热煮沸处理,目的是 _____________ 。
(4)为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为 。
22.(本题共11分)向密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示。乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂(已知t0-t1阶段c(B)未画出)
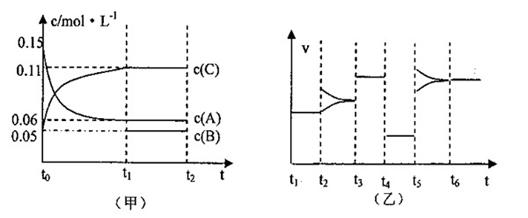
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率v(C)为= 。
(2)若t2—t3阶段,C的体积分数变小,此阶段v(正) v(逆)(填“>”“<”“=”)
(3)t4—t5阶段改变的条件为 ,B的起始物质的量为 。
(4)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 选项 | C | A | C | B | D | A | C | D | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 选项 | C | C | D | C | B | A | A | D | D |
19 (本题共11分) (1) (2)H2O(2分)
(3)A12O3(1分),两性氧化物(1分),![]()
![]()
![]() H2O+H++A1O2- A1(OH)3 A13++3OH(2分)
H2O+H++A1O2- A1(OH)3 A13++3OH(2分)
(4)氧化(1分),SO2+C12+2H2O=4H++SO42-+2C1(2分)
20. (12分,每空2分)(1)2C+SiO2=高温Si+2CO↑
(2)2Fe2++Cl2=2Fe3++2Cl-
H
: :
(3)〔 H∶N∶H〕+ 〔∶Cl∶〕- 4NH3+5O2Pt=△ 4NO+6H2O
: :
H
(4)O=C=O C+4HNO3(浓)=△ CO2↑+4NO2↑+2H2O
21.(本题共12分)
(1)Fe (1分), Fe-2e-=Fe2+ (1分) (2)C,B (各1分)
(3)隔绝空气,防止生成的Fe(OH)2被空气氧化 (2分)
排净溶液中溶解的氧气,防止生成的Fe(OH)2在溶液中被氧化 (2分)
(4)B、C (2分)
(5)白色沉淀迅速变为灰绿色,最后变为红褐色 (2分)
22 .(本题共11分)
(1)0.004mol/(L.s) (2分) (2)< (2分)
(3)降低压强 0.04mol (4分)
![]() (4)3A(g)
B(g)+2C(g);△H=+100akJ·mol-1 (3分)
(4)3A(g)
B(g)+2C(g);△H=+100akJ·mol-1 (3分)