08届高三年级化学十月联考试卷
注意事项:
1.本试卷共5页,满分110分,考试时间90分钟
2.答卷前,考生必须在试卷答题卡的密封线内将自己所在学校、姓名、班级、考号填写上
3.将第I卷和第II卷的答案均填写在试卷答题卡相应的位置上
4.答题时可能用到的相对原子质量(原子量):H-1 C-12 Fe-56 O-16 Na-23 Cl-35.5
第I卷(共54分)
以下1至18题,每小题给出的四个选项中,只有一个选项符合题意. 每小题3分,共54分.
1.2007年6月,“八国峰会”再次就温室气体减排问题展开磋商并初步达成共识。为减少二氧化碳这种温室气体的排放,下列措施不切实际的是
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
2.下列说法正确的是:
A.H与D,16O2与18O2互为同位素
B.H216O、D216O、H218O、D218O互为同素异形体
C.在NaCl晶体中,每个氯离子周围都有8个钠离子
D.L层电子为奇数的所有短周期元素所在族的序数与该元素原子的L层电子数相等
3.X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A.HX B.H2X C.XH3 D.XH4
4.苹果酸是一种常见的有机酸,结构简式为![]() ,苹果酸可能发生的反应是
,苹果酸可能发生的反应是
①与NaOH溶液反应 ②与石蕊试液作用变红 ③与金属钠反应放出气体 ④一定条件下与乙酸酯化 ⑤一定条件下与乙醇酯化
A.①②③ B.①②③④ C.①②③⑤ D.①②③④⑤
5.下列分子的比例模型中,中心原子上存在孤对电子的是
A. B.
B.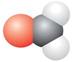
C.![]() D.
D.
6.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.100g98%的浓硫酸中含氧原子个数为4×6.02×1023
B.5.6 g铁粉与硝酸反应失去的电子数一定为3×6.02×1022
C.标准状况下,22.4LCH4和CH3Cl的混合物所含有的分子数目为6.02×1023
D.6.2g氧化钠和7.8g过氧化钠的混合物中所含有的离子总数约为7×6.02×1022
7.关于锂、钠、钾、铷、铯的性质递变规律,不正确的叙述是
A.单质的密度依次增大 B.单质的熔沸点依次降低
C.单质的还原性依次增强 D.离子的氧化性依次减弱
8.下列指定微粒的个数比为2∶1的是
A.Be2+离子中的质子和电子
B.![]() 2中的中子和质子
2中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子 D.BaO2(过氧化钡)固体中的阴离子和阳离子
9.下列各组离子,在指定的环境中一定能大量共存的是
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN-
B.含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
D.含有大量ClO-的溶液:H+、Mg2+、I-、SO42-
| A | B | C | ||
| D | E |
10.下表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,错误的是
A.A与B形成的阴离子可能有AB32—、A2B42—
B.E的氢化物的稳定性小于C 的氢化物的稳定性
C.D在适量的B中燃烧的产物为DB3
D.A与E形成的分子是非极性分子
11.在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为
A.![]()
![]() B.
B.![]()
C.![]() D.
D.![]()
12.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.在相同条件下,单质与同浓度稀盐酸反应的速率:L>R
B.只有T形成的化合物具有两性
C.Q、T两元素的氢化物分子间都存在氢键
D.L、Q形成的简单离子核外电子数相等
13.依照阿佛加德罗定律,下列叙述正确的是
A . 同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种气体的质量之比等于密度之比
D. 同温同体积下两种气体的物质的量之比等于压强之比
14. 将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
![]()
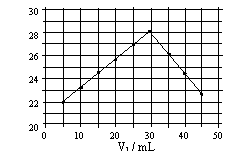 A. 做该实验时环境温度为22℃
A. 做该实验时环境温度为22℃
B. 该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0mol/L
D. 该实验表明有水生成的反应都是放热反应
15.下列反应的离子方程式正确的是
A. 次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2
== CaCO3¯+2HClO
B. 硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+
== Fe3++4H2O
C. 用氨水吸收少量二氧化硫 NH3.H2O+SO2
== NH![]() +HSO
+HSO![]()
D. 硝酸铁溶液中加过量氨水Fe3++3NH3.H2O ==
Fe(OH)3¯+3NH![]()
16.根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是
A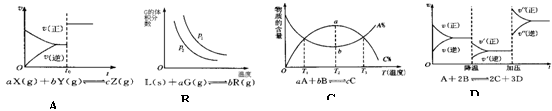 .密闭容器中反应达到平衡,t0时改变某一条件有如图所示,则改变的条件一定是加入催化剂
.密闭容器中反应达到平衡,t0时改变某一条件有如图所示,则改变的条件一定是加入催化剂
B.反应达平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
D.反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体
17.下列实验操作中错误的是
A.用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出
B.蒸发结晶时,应将溶液蒸干,并放在干燥器中冷却
C.无锈的细铁丝可以代替铂丝,做焰色反应的工具
D.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
18.pH相同的四种一元 酸A、B、C、D的溶液各20 mL,与过量Mg充分反应后,产生氢气的质量是D>C>A=B。下列说法正确的是:
①D的酸性最强 ②A与B的酸性最强且彼此相当 ③反应后原D溶液的pH最大 ④反应后原A和B溶液的pH最大 ⑤反应前D溶液的物质的量浓度最大 ⑥反应前四种溶液的物质的量浓度一样大
A.②③⑤ B.①④⑥ C.②④⑤ D.①③⑤
第II卷(共56分)
19. (本题共6分). 第三周期元素中 ⑴元素的最高价氧化物所对应的水化物.其中酸性最强的酸是 ;⑵形成的共价单质中键长最长的是 键;键长最短的是 键⑶形成的非金属单质晶体中熔点最高的是 ,最低的是 .⑷形成的金属晶体中熔点最高的是
20.(本题共6分) 在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类。请选出各组的例外元素,并将该组其他元素的可能归属按所给6种类型的编号填入表内。
| 元素组 | 例外元素 | 其他元素所属类型编号 |
| ⑴S、N、Na、Mg | ||
| ⑵P、Sb、Sn、As | ||
| ⑶Rb、B、Te、Fe |
归属类型:①主族元素 ②过渡元素 ③同周期元素 ④同族元素 ⑤金属元素 ⑥非金属元素
21.(本题共9分) 有一瓶溶液只含Cl-、![]() 、
、![]() 、Na+、
、Na+、![]() 、K+、Mg2+ 七种离子中的某几种。经实验:
、K+、Mg2+ 七种离子中的某几种。经实验:
(1) 原溶液 ![]() 白色沉淀
白色沉淀
(2) 将(1)所得溶液 ![]() 放出使紫色石蕊试液变蓝的气体
放出使紫色石蕊试液变蓝的气体
(3) 原溶液中加BaCl2溶液不产生沉淀
(4)原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)原溶液中一定含有的离子是_____________________,一定不含有的离子是
可能含有的离子是
(2)有同学认为实验(4)可以省略,你认为呢?(填“可以”或“不可以”)
说明理由
(3)可能含有的离子如何加以确定?
22.(本题共8分) 科学家用NaNO3和Na2O在一定条件下化合制得晶体A,A由钠离子和某阴离子B构成, 则:
(1)A的化学式为 A 与Na3PO4比较,化学活泼性比Na3PO4 (填“强”或“弱”),阴离子B的空间立体结构形状最有可能是 ;
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为: ;
23.(本题共8分) 已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。②X在A、B、C、D中都不呈现它的最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
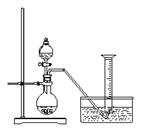 24.(本题共11分) 某同学设计了如下方案,来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况)。
24.(本题共11分) 某同学设计了如下方案,来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况)。
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品中过氧化钠的含量。
实验步骤:
①称取过氧化钠样品2.00 g ;
②把这些过氧化钠样品放入气密性良好的气体发生装置中;
③向过氧化钠样品中滴入水,用量筒排水集气,量筒内液面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容。
请回答下列问题:
(1)有1000 mL、 500 mL 、250 mL的量筒备用,则应选用 mL的量筒。
(2)生成气体体积是 mL, 为保证生成气体体积的准确性.读取量筒刻度时应注意的问题是 。
(3)据研究,与上述反应同时发生的反应还有:Na2O2 + 2H2O = 2NaOH + H2O2,H2O2的生成会使测定结果 (填“偏高”或“偏低”)。
(4)为校正实验结果,该学生补做了如下实验:用移液管移取20.00 mL容量瓶中的液体,放入锥形瓶中,用0.0100 mol/L的KMnO4溶液去测定,至溶液中刚好出现浅浅的紫红色,停止滴定,用去了24.00 mLKMnO4溶液。配平化学反应式方程式:
KMnO4 + H2O2 + H2SO4 —— K2SO4 + MnSO4 + O2↑ + H2O
该实验应选用 式滴定管。
(5)通过以上数据计算,该过氧化钠的纯度为 。
(6)如何避免因为生成H2O2造成的误差? 。
25. (本题共8分) 当m mol Na2O2与NaHCO3的混合物在密闭容器中加热至250°C,使其充分反应,混合物中Na2O2的物质的量分数为x
(1)当x= 1/2 时,容器中固体产物是(写化学式) ,其物质的量为
(2)若反应后生成气体是O2和H2O,则x的取值范围________________________ _。
(3)若0<x< 1/3 时,产生气体的物质的量n= mol(用m、x表示)