08届高三年级化学第一学期期中考试试题
注意:考试时间100分钟,总分100分。
所有答案必须填在答题卷规定位置!不得使用计算器!
可能用到的相对原子质量:H-1,O-16,S-32,Cl-35.5,K-39
第Ⅰ卷
一、选择题(单选题,每题2分,共44分)
1.2005年美国《Science》上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构。这种超原子具有40个价电子时最稳定。请预测稳定的Al13所带的电荷为
A.-1 B.0 C.+2 D.+3
2.有合成氨3H2+N2![]() 2NH3 现有A、B、C、D四只容器中,每个容器中有两种操作,两种操作分别达到平衡后,N2和NH3转化率之和不为1的是(起始体积相同):
2NH3 现有A、B、C、D四只容器中,每个容器中有两种操作,两种操作分别达到平衡后,N2和NH3转化率之和不为1的是(起始体积相同):
A.恒温恒容:操作一:加1mol N2和3mol H2; 操作二:加2molNH3
B.恒温恒压:操作一:加1mol N2和3mol H2; 操作二:加2molNH3
C.恒温恒容:操作一:加1mol N2和3mol H2; 操作二:加3molNH3
D.恒温恒压:操作一:加1mol N2和3mol H2; 操作二:加3molNH3
3.25℃时,PH和体积均相等的氨水和烧碱溶液中c(NH4+)与c(Na+)关系正确的是
A.c(NH4+)>c(Na+) B.c(NH4+)=c(Na+)
C.c(NH4+)<c(Na+) D.无法判断
4.化学反应前后肯定没有变化的是
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
A.①④ B.①③⑤ C.①③④ D.①②③④
5.下列反应的离子方程式正确的是
A.铜片插入氯化铁溶液中 Cu+Fe3+=Cu2++Fe2+
B.电解饱和食盐水 2Cl—+2H+![]() H2↑+C12↑
H2↑+C12↑
C.向溴化亚铁溶液中通入过量的氯气![]() 2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
 NH4++Al3++2SO42—+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
NH4++Al3++2SO42—+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
6.最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物
B.14N原子核内的中子数为7
C.N4沸点比P4(白磷)高
D.1molN4气体转变为N2吸收882kJ热量
7.下列各组离子能在指定溶液中共存的是
①无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
②使pH试纸变深蓝的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
③水电离的![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
④加入Mg能放出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
⑤使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
⑥pH=0的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
A.①③ B.②④⑤ C.①②⑤ D.③⑥
8.下列图式正确的是
A.氟化氢的电子式:![]()
B.次氯酸的结构式: H-Cl-O
C.铝离子的结构示意图![]()
D.氯化铯的晶体结构(晶胞)模型:![]()
9.从植物花中提取一种有机物,可用简化式HIn表示,在水溶液中因存在下列电离平衡:HIn(溶液红色) ![]() H+(溶液)+In-(溶液黄色),故可作酸碱指示剂。在该水溶液中加入下列物质,能使该指示剂显黄色的是
H+(溶液)+In-(溶液黄色),故可作酸碱指示剂。在该水溶液中加入下列物质,能使该指示剂显黄色的是
A.碳酸钠溶液 B.过氧化钠 C.氯化钠溶液 D. 盐酸
10.下列操作中,能使电离平衡H2O![]() H++OH–,向右移动且溶液呈酸性的是
H++OH–,向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100°C,使pH=6
11.准确量取25.00 mL的酸性KMnO4溶液,可选用的仪器
A.50 mL量筒 B.10 mL量筒
C.50 mL碱式滴定管 D.50 mL酸式滴定管
阅读下述信息回答12-14题
氟里昂(如CCl2F2)破坏臭氧层的有关反应如下:(氟里昂在光的作用下产生Cl原子,臭氧为O3)
![]()
![]()
![]()
![]()
12.在上述臭氧变成氧气的反应过程中,Cl是
A.反应物 B.生成物 C.中间产物 D.催化剂
13.O3和O2是
A.同分异构体 B.同系物 C.氧的同素异形体 D.氧的同位素
14.上述臭氧变成氧气的过程属于
A.化学变化、非氧化还原反应 B.化学变化、氧化还原反应
C.物理变化、非氧化还原反应 D.物理变化、氧化还原反应
15.U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解,UO2(NO3)2 —— UxOY + NO2↑+ O2↑,在600K时,将气体产物收集于试管中并倒扣于中气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是
A.UO2 B.UO3 C.2UO2·UO3 D.UO2·2UO3
16.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:
①2MoS2 + 7O2 ![]() 2MoO3 + 4SO2;
2MoO3 + 4SO2;
②MoO3 + 2NH3·H2O = (NH4)2MoO4 + H2O;
③(NH4)2MoO4 + 2HCl = H2MoO4↓+ 2NH4Cl;
④H2MoO4 = MoO3 + H2O;
⑤ 用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3不溶于氢氧化钠溶液
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2
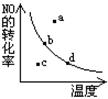 17.右图里的曲线是在其它条件一定时,2NO+O2
17.右图里的曲线是在其它条件一定时,2NO+O2 ![]() 2NO2;(△H<0)反应中NO的转化率与温度的关系曲线。图中标有a、b、c、d等四点,其中表示未达到平衡状态,且V(正)>V(逆)的点是
2NO2;(△H<0)反应中NO的转化率与温度的关系曲线。图中标有a、b、c、d等四点,其中表示未达到平衡状态,且V(正)>V(逆)的点是
A.a点
B.b点
C.c点
D.d点
18.下面关于N2+3H2![]() 2NH3;(△H<0)的平衡移动,(如右图)影响平衡移动的原因可能是:
2NH3;(△H<0)的平衡移动,(如右图)影响平衡移动的原因可能是:
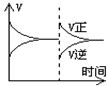 A.升高温度,同时加压
A.升高温度,同时加压
B.减小压强,同时降温
C.增大反应物浓度,使用催化剂
D.增大反应物浓度,同时减少生成物浓度
19.90℃时水的离子积Kw=3.8×10—13,该温度时纯水的pH
A.小于7 B.等于7 C.大于7 D.无法确定
20.4体积的pH=9的Ca(OH)2溶液与1体积的pH=13的NaOH溶液混合后,溶液中氢离子浓度为
A.5×10-13mol/L B.2×10-12mol/L
C.![]() (l×10-1+4×10-5)mol/L D.
(l×10-1+4×10-5)mol/L D.![]() (l×10-13+4×10-9)mol/L
(l×10-13+4×10-9)mol/L
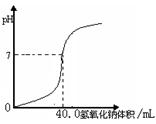 21.常温下,用1.0 mol·L-1 NaOH 溶液中和某浓度硫酸溶液时,其pH和所加NaOH 溶液的体积关系如右图所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是:
21.常温下,用1.0 mol·L-1 NaOH 溶液中和某浓度硫酸溶液时,其pH和所加NaOH 溶液的体积关系如右图所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是:
A.1.0 mol·L-1,60mL
B.0.5 mol·L-1,80mL
C.0.5mol·L-1,40mL
D.1.0 mol·L-1,80mL
22.下列装置中属于原电池的是( ),属于电解池的是 ( )
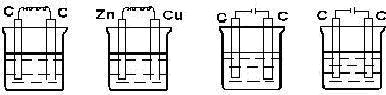
A B C D
稀硫酸 稀硫酸 稀硫酸 二硫化碳
第Ⅱ卷
23.(9分)
某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氧化铅,其中Pb为+2价,N平均为-1/3价)六种物质,已知Pb(N3)2是反应物之一。根据你学过的有关化学定律和知识,回答下列问题:
(1)铅(Pb)的常见化合价是 ,将Pb3O4写成常见化合价的氧化物的形式为 __ (已知Fe3O4可写成FeO·Fe2O3)。
(2)已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 ,Mn的化合价为 。
(3)Pb(N3)2在该反应中是 剂,它的产物是 ,1mol Pb(N3)2参加反应,转移电子数是 mol。
24.(7分)
A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生产盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素离子的结构示意图是 。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是 。(填化学式),B的10电子氢化物的分子空间构型为 。
(3)B与E可形成离子化合物BE5、BE5的电子式是 ,含有的化学键类型有 。
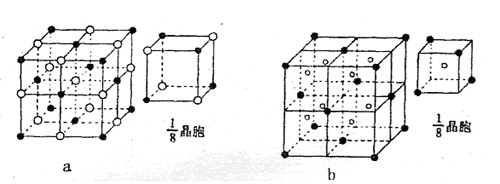
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物结构是 (填字母标号a或b)
25.(8分)
(1)将等体积等物质的量浓度的盐酸和氨水混合后,呈_____性,溶液中C(NH4+)与C(Cl-)的大小关系是___________________;
(2)将PH=3的盐酸和PH=11的氨水等体积混合后溶液呈_____性,溶液中C(NH4+)与C(Cl-)的大小关系是___________________;
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中C(NH4+)与C(Cl-)浓度相等,则混合溶液呈_____性,盐酸与氨水体积大小关系是_________________;
(4)将m mol· L-1的盐酸和n mol·L-1氨水等体积混合后,溶液的PH=7,m与n的大小关系是____,则盐酸中C(H+)与氨水中C(OH-)的大小关系是_______;
26.(7分)
(1)某学生中和滴定实验的过程如下:
a. 取一支碱式滴定管,
b. 用蒸馏水洗净,
c. 即加入待测的氢氧化钠溶液,
d. 记录液面刻度读数,
e. 用酸式滴定管精确放出一定量标准溶液,
f. 置于未经标准酸液润洗过的洁净锥形瓶,
g. 加入适量蒸馏水,
h. 加入酚酞2滴,
i. 滴定时,边滴边摇荡,
j. 边注视滴定管内液面刻度读数,
k. 当小心滴到溶液由无色变为粉红色时,即停止滴定,
l. 记录液面刻度读数,
m. 根据滴定管的两次读数得出NaOH溶液的体积为22 mL。
指出实验过程中的错误之处(用编号表示): (注:错一处,倒扣一分,但本小题不出现负分。)
(2)下图为常见仪器的部分结构(有的仪器被放大)
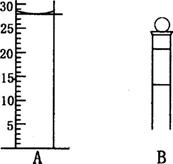
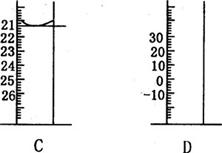
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
27.(3分)
将等体积的0.4 mol/L CH3COONa溶液与0.2 mol/L HNO3溶液相混合,混合液中各离子浓度按由大到小的顺序排列为_______________________________。
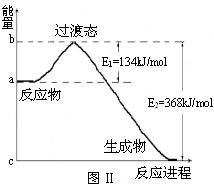 28.(5分)
28.(5分)
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/ kJ·mol–1 | 197 | 360 | 499 | X |
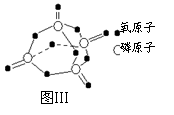
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X= 。
29.(5分)
已知Cl2、Al2(SO4)3、CaC2、C2H5Br、CH3COCH3等物质均能与水反应,反应中各物质和水分别解离成两部分,然后两两重新组合形成新的物质。今有下列五种物质,常温下很容易与水发生反应:
![]()
试问:
(1)在后面所给出的五种物质与水反应的产物中,属于最高价氧化物的水化物的是 ,属于无氧酸的是 。
(2)分别将0.01 mol的这五种物质放入0.1 L水中反应,结果使溶液的pH值接近3的原物质是 。
30.(6分)
恒温下,将a mol N2和b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3 H2(g)![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值 。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25% 。计算平衡时NH3的物质的量 。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,α(N2):α(H2) = 。
(6)平衡混合气体中,n(N2):n(H2):n(NH3) =
31.(6分)
把密度为1.68g / cm3的液态S2Cl2 10 mL 溶于石油醚(一种溶剂),得到100mL溶液,把它慢慢加入50 mL3.2mol/L的SO2 水溶液中,振荡使之充分反应,当加入的S2Cl2 溶液为64.3mL时,恰好反应完全。生成物用含0.32mol KOH的KOH溶液中和后,恰好完全转化为KCl 和一种二元含氧酸的钾盐晶体。试通过计算确定S2Cl2 与SO2 在溶液中反应的化学方程式。
参考答案
一、选择题(单选题,每题2分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | |
| 选项 | A | C | B | C | D | B | B | D | A | B | D | |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | |
| 选项 | D | C | A | B | D | C | D | A | A | B | B | C |
23.(9分)(一个答案1分)
(1)+2、+4,2PbO·PbO2
(2)+2,+7
(3)还原,NO、Pb3O4,44/3mol。
24.(7分)(一个答案1分)
(1)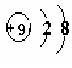
(2)NH3,三角锥型
(3)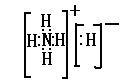 , 共价键、离子键
, 共价键、离子键
(4)b
25.(8分)
(1)酸 ,C(Cl-)>C(NH4+) ;
(2)碱 ,C(NH4+)>C(Cl-);
(3)中 ,V(氨水)>V(盐酸);
(4) m<n ,C(H+)>C(OH-)。
26.(7分)
(1)c、j、k、m (3分)
(2)28.0mL,C
27.(3分)
C(Na+)>C(CH3COO-)>C(NO3-)>C(H+)>C(OH-)>
28.(5分)
(1) NO2(g)+CO(g)= NO(g)+CO2(g);ΔH=-234 kJ/mol ;
(2)X= 433.75 (2分)。
29.(5分)( 每个物质1分,(2)中有BrCl不倒扣)
(1)Mg(OH)2 H2SiO4,HCl;
(2)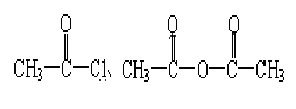 。
。
30.(6分)(各1分)
(1)a的值 16
(2)NH3的物质的量 8mol
(3)n(始):n(平)= 5:4
(4)a:b= 2:3
(5)α(N2) :α(H2) =1:2
(6)n(N2):n(H2):n(NH3) =3:3:2
31.(6分)
参加反应的S2Cl2 的物质的量
n(S2Cl2 )= 1.68g/cm3×10mL×64.3mL/100mL×135g/mol =0.08mol (1分)
参加反应的SO2 的物质的量n(SO2 )=50mL×10-3L/mL×3.2mol/=0.16 mol (1分)
生成HCl 的物质的量n(HCl)= 2 n(S2Cl2 )= 2×0.08mol=0.16mol (1分)
生成二元酸的物质的量n(二元酸)==( 0.32 mol– 0.16mol)/2 = 0.08mol (1分)
故反应中n(S2Cl2 ):
n(SO2 ):n(HCl):n(二元酸)= 0.08:0.16:0.16:0.08= 1:2:2:1 (1分)
所以反应式为:S2Cl2 +2 SO2 +2H2O=2HCl + H2S4O6 (1分)