08届高三年级化学第一学期期末考试试卷
化学试卷
本试卷分第Ⅰ卷和第Ⅱ卷,第Ⅰ卷为选择题,共50分,第Ⅱ卷为非选择题,共60分,满分110分,考试时间为90分钟。将第Ⅰ卷选择题的答案涂在答题卡中。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27
Si:28 S:32 Cl:35.5 K:39 Fe:56 Cu:64 I:127 Ba:137
第Ⅰ卷(选择题,共50分)
一、 单项选择题(本小题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意)
1. 最近我国科学家开发出第五形态的固态碳,外形类似海绵,并具有磁性,这种固体碳与金刚石的关系是( )
A. 同系物 B. 同位素 C.同分异构体 D.同素异形
2. 材料是社会进步的标志,下列物质不属于有机合成材料的是( )
A. 塑料 B. 合成纤维 C. 玻璃 D. 合成橡胶
3. 25℃时将稀氨水逐滴加入到稀盐酸中,当溶液的pH=7时,c(NH4+)与c(Cl-)大小关系正确的是( )
A . c(NH4+)=c(Cl-) B. c(NH4+)>c(Cl-)
C. c(NH4+)<c(Cl-) D. 无法确定
4. 向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸氢钠溶液中滴加稀硝酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.高锰酸钾溶液中滴加亚硫酸钠溶液
5. 下列物质不能与二氧化硫气体反应的是( )
A.品红溶液 B.氯水 C.浓硫酸 D.碱石灰
6. 下列分离或提纯物质的方法错误的是( )
A. 用渗析的方法精制淀粉胶体
B. 用盐析的方法分离、提纯蛋白质
C. 用加热的方法提纯含有少量氯化铵的氯化钠固体
D. 用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
7.
在容积不变的密闭容器中,可逆反应:4A(g)+5B(g)![]() 3C(g)+6D(g);△H<0,达到化学平衡状态的标志是( )
3C(g)+6D(g);△H<0,达到化学平衡状态的标志是( )
A. 气体密度不再发生变化
B. A的物质的量浓度不再变化
C. 容器内压强不再变化
D. 单位时间内消耗4n molA,同时消耗5n molB
8. 下列说法正确的是( )
A. 牛油、甘油、汽油都属于酯类物质
B. Na、Al、Cu可以分别用置换法、热还原法和电解法冶炼得到
C. 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
D. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
9. 在实验室中按下述方法制备气体,正确的是( )
A. 锌粒与稀硝酸反应制备H2
B. 二氧化锰和稀盐酸加热反应制备Cl2
C. 氢氧化钠溶液与氯化铵固体反应制备NH3
D. 大理石与稀盐酸反应制备CO2
10. 高锰酸钾和氢溴酸溶液可以发生下列反应:KMnO4+HBr→Br2+MnBr2+KBr+H2O,若消耗0.1mol氧化剂,则转移的电子为( )
A. 0.5mol B. 0.4mol C. 0.3mol D. 0.2mol
二、 单项选择题(本小题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
11. 室温下,强酸性溶液中能大量共存的离子组是( )
A. NH4+、Cu2+、Cl-、NO3- B. K+、Na+、SO32- S2-
C. K+、Na+、AlO2-、SO42- D. Ba2+、Fe2+、NO3-、Br-
12. 设NA为阿伏加德罗常数的值,下列有关NA的说法正确的是( )
A. 在标准状况下,11.2L己烷所含有的原子数为10NA
B. 0.1mol/L氢氧化钠溶液中含有钠离子数为0.1NA
C. 100mL2.0mol/L醋酸溶液中分子总数为0.2NA
D. 2.7gAl与足量的硫酸反应转移的电子数为0.3NA
13. 下列离子方程式正确的是( )
A. Fe(OH)3与HCl溶液:Fe(OH)3+3H+=Fe3++3H2O
B. 氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C. 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
D. 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
14. 向某电解质溶液中插入两根石墨电极,通直流电一段时间后,测得阴、阳两极析出产物的物质的量之比为2:1,则该电解质溶液可能是( )
A. 盐酸 B. 硫酸溶液 C. 氯化钠溶液 D. 硝酸银溶液
15.
25℃时,水的电离达到平衡:H2O![]() H+ + OH—;△H>0,下列叙述正确的是( )
H+ + OH—;△H>0,下列叙述正确的是( )
A. 将水加热到90℃,pH不变
B. 向水中加入醋酸钠固体,pH变小
C. 向水中加入稀氨水,KW变大
D. 向水中加入少量的硫酸氢钠,KW不变
16. ag铁粉与含有硫酸的硫酸铜溶液完全反应后,得到ag铜,则参与反应的硫酸与硫酸铜的物质的量之比为( )
A. 1:7 B. 7:1 C. 7:8 D. 8:7
17. 下列关于实验现象的描述不正确的是( )
A. 把铜片和铁片紧靠在一起侵入稀硫酸中,铜片表面出现气泡
B. 用铜板做电极电解硫酸铜溶液,阴极铜板质量增加
C. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D. 锌粒与盐酸反应时,加入几滴氯化铜溶液,气泡放出速率加快
18. 下列说法正确的是( )
A. 原子晶体中只存在非极性共价键
B. 稀有气体形成的晶体一定属于分子晶体
C. 干冰升华时,分子内共价键会发生断裂
D. 含有金属阳离子的晶体一定是离子晶体
19.
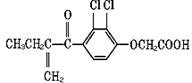 利尿酸在北京2008年奥运会上被禁用,它是一种兴奋剂,其结构简式如下图所示。下列叙述正确的是( )
利尿酸在北京2008年奥运会上被禁用,它是一种兴奋剂,其结构简式如下图所示。下列叙述正确的是( )
A. 该有机物分子式为C13H16O4Cl2
B. 1mol利尿酸能与6molH2发生加成反应
C. 利尿酸能使溴水褪色
D. 利尿酸能与氯化铁溶液发生显色反应
20. 短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族。W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是( )
A. WX2分子中所有原子最外层都为8电子结构
B. WX2、ZX2的化学键类型和晶体类型都相同
C. WX2是以极性键结合成的非极性分子
D. 原子半径大小顺序为X<W<Y<Z
第Ⅱ卷(非选择题,共60分)
三、 填空题(本小题包括2小题,共16分)
21.(8分)A、B、C、D是四种可溶的化合物,分别由阳离子Na+、Ba2+、Al3+、Fe3+和阴离子OH—、CO32—、NO3—、SO42—两两组合而成,它们的溶液之间能发生如下反应:
①A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
②C与D反应生成有色沉淀。
③B与C反应生成白色沉淀。
写出它们的化学式:A ,B ,C ,D 。
22.(8分)X、Y、Z是三种短周期元素,甲、乙、丙为化合物,其转化关系如下:
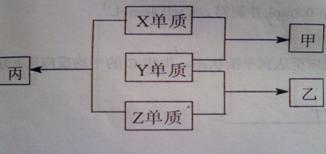
请回答:
(1)欲实现上图的转化,在X、Y、Z中最多有 种是金属元素。
(2)若甲、乙分子中均含有10个电子,且甲分子中含有3个原子,乙分子中含有4个原子,则乙是 ,丙是 。
(3)若甲和单质Z均为淡黄色固体,则甲和水反应的化学方程式为: ;
已知8g单质Z完全燃烧放出热量为aKJ,请写出该反应的热化学方程式: 。
四、 实验题(本小题包括2小题,共17分)
23、(3分)下列实验操作或对实验事实的叙述正确的是 (填序号)。
①用氨水清洗做过银镜反应的试管;
②用分液漏斗分离硝基苯和水的混合物;
③用湿润的pH试纸测定稀盐酸的pH;
④用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液
⑤将Na2CO3固体在瓷坩埚中加热熔融;
⑥不慎将苯酚溶液沾到皮肤上,立即用NaOH稀溶液清洗
⑦向沸腾的NaOH溶液中滴加FeCl3溶液,制备Fe(OH)3胶体
⑧配制FeSO4溶液时,需加入少量铁粉和稀硫酸
24、(14分)碳酸钠和碳酸氢钠是重要的工业原料。某化学活动小组为探究它们的性质并测定某天然碱的成分进行了下述试验。
Ⅰ.向Na2CO3溶液中滴入酚酞试液后显红色,原因是(写离子方程式) 。向上述溶液中滴入过量的CaCl2溶液,观察到的现象是: 。
Ⅱ.某天然碱的组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)。现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g。实验时忽略装置内空气中的CO2和水蒸气。
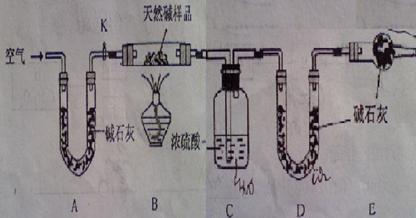
请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明 。
(2)NaHCO3受热分解的化学反应方程式为: 。
(3)E处碱石灰的作用是: 。
(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是: 。
(5)实验结束后称得洗气瓶C质量增加0.9g,U型管D质量增加1.1g,则该天然碱的化学式为: 。
五、 有机推断(本小题包括2小题,共16分)
25.(6分)碳、氢、氧3种元素组成的有机物A,相 对分子质量为102,含氢的质量分数为9.8%,A分子氢原子个数为氧原子个数的5倍。
(1)A的分子式是 。
(2)A有多种同分异构体,其中含有羧基的同分异构体数目为 个。
(3)若A有2个不同的含氧官能团且能发生银镜反应,其官能团的名称是 、 。
26.(10分)有机物H(C9H10O2)是一种有茉莉花香味的无色油状液体,可用于配制香精,它的合成过程如下图所示。其中A为气态烃,在标准状况下,1.4g气体A的体积为1.12L;F是只含有C、H、O元素的化合物,且分子结构中没有甲基。(部分反应的条件及产物已省略)
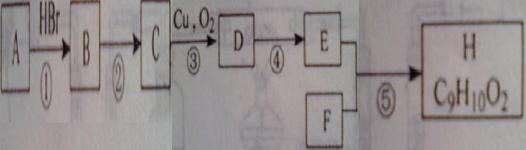

请回答下列问题:
(1)①、④的反应类型分别为 、 。
(2)化合物A、F的结构简式分别为: 、 。
(3)写出反应③的化学方程式: 。
(4)写出反应⑤的化学方程式: 。
六、 计算题(本小题包括2小题,共11分)
27.(5分)将钠铝混合物10g放入水中,待反应完全后固体无剩余,共收集到8.96L氢气(标准状况)。
(1)写出该实验中发生反应的化学方程式:
① ;
② 。
(2)该混合物中钠和铝的物质的量之比为 。
28.(6分)在一定温度下,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() χC(g),2min时反应达到平衡(温度不变),B剩余0.8molB,并测得c(C)=0.4mol/L。
χC(g),2min时反应达到平衡(温度不变),B剩余0.8molB,并测得c(C)=0.4mol/L。
请填写下列空白
(1)从平衡反应至达到平衡状态,生成C的平均反应速率为 。
(2)χ= 。
(3)如果向上述容器中再通入3molA和1molB,反应达到平衡时,C的物质的量分数为 。
高三年级第一学期期末考试
化学试题参考答案
1、 D
2、 C
3、 A
4、 A
5、 C
6、 D
7、 B
8、 C
9、 D
10、 A
11、 A
12、 D
13、 A
14、 B
15、 D
16、 A
17、 C
18、 B
19、 C
20、 D
21、 A:Ba(OH)2 B:Al2(SO4)3 C:Na2CO3 D:Fe(NO)3
22、 (1)1(2分)(2)NH3,NO(2分)
(3)2Na2O2+2H2O=4NaOH+O2↑
S(s)+O2(g)=SO2(g);△H=—4akJ/mol(4分)
23、②⑧
24、(每空2分)
ⅠCO32-+H2O![]() HCO3-+OH-;产生白色沉淀,且溶液红色退去
HCO3-+OH-;产生白色沉淀,且溶液红色退去
Ⅱ(1)样品重于砝码
(2)2NaHCO3=Na2CO3+H2O+CO2↑(条件加热)
(3)防止空气中的CO2和水蒸气进入U型管中
(4)使反应产生的CO2和水蒸气被充分吸收
(5)Na2CO3·2NaHCO3·H2O
25、(1)C5H10O2 (2分) (2)4 (2分)
(3)羟基,醛基(每空1分)
26、略
27、(1)(4分)2Na+2H2O=2NaOH+H2↑
2NaOH+2H2O+2Al=2NaAlO2+3H2↑
(2)(1分)1:1
28、(6分)(1)0.20mol/L·min (2)4 (3) 20%