08届高三化学第一次模拟考试试题
高三化学试题
可能用到的相对原子质量:H 1 C 12 O 16 A1 27 K 39 Ca 40 Ti 49 Fe 56
第Ⅰ卷 (选择题 共48分)
一、单项选择题:本题包括8小题,每小题3分,共计24分。每小题只有一个选项符合题意。
 1.2007年诺贝尔化学奖得主——德国科学家格哈德·埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
1.2007年诺贝尔化学奖得主——德国科学家格哈德·埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
A.催化转化器中的铂催化剂可加快 CO 氧化
B.铂表面做成蜂窝状更有利于提高催化效果。
C.在铂催化下,NO、NO2 可被 CO 还原成 N2
D.碳氢化合物在铂催化下,被 CO 直接氧化成 CO2和 H2O
2.下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H=—483.6kJ/mol,则氢气的燃烧热为241.8kJ
B.已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=—57.4kJ/mol
D.己知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,则△H1>△H2
3.汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中错误是
A.用盐的形式表示:BaSiO3·CuSiO3
B.用氧化物形式表示:BaO·CuO·2SiO2
C.易溶于强酸、强碱
D.性质稳定,不易褪色
4.下列有关实验的说法正确的是
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32
5.X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物强碱,Z的原子半径最小。据此判断下列说法不正确的是
A.X是第ⅠA元素,Z是第ⅦA元素
B.X、Y、Z三种元素的最高化合价逐渐减小
C. Z的最高价氧化物对应的水化物是强酸
D.X、Z形成的化合物是离子化合物
6.下列反应的离子方程式书写正确的是
A.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.浓烧减溶液中加入铝片:Al+2OH-=AlO2-+H2↑
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
7.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6![]() CoO2+LiC6,下列说法正确的是
CoO2+LiC6,下列说法正确的是
A.充电时,电池的负极反应为 LiC6—e-=Li++C6
B.放电时,电池的正极反应为 CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
8.金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:aTiO2 + bCl2 + cC ![]() aTiCl4 + cCO
……反应①
aTiCl4 + cCO
……反应①
TiCl4 +2Mg ![]() Ti + 2MgCl2 ……反应②
Ti + 2MgCl2 ……反应②
关于反应①、②的分析不正确的是
① TiCl4在反应①中是还原产物,在反应②中是氧化剂;② C、Mg在反应中均为还原剂,被还原;③ 在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;④ a=1,b=c=2;⑤ 每生成19.6 g Ti,反应①、②中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
二、不定项选择题:本题包括8小题,每小题4分,共计32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。
9.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.32g含有少量臭氧的氧气中,共含有氧原子1.204×1024
B.在标准状况下,2.24L己烷中所分子数约为6.02×1023
C.2.7g铝与足量氢氧化钠溶液反应转移的电子数约为1.806×1023
D.12.5 mL 16 mol/L浓硫酸与足量铜反应,生成SO2的分子数约为6.02×1022
10.下列各组离子可能大量共存的是
A.pH=1的溶液中:Fe2+、Al3+、HCO3—、MnO4—
B.常温下水电离出的c(H+)·c(OH—)=10—20的溶液中:Na+、C1—、S2—、SO32—
C.能与金属铝反应放出氢气的溶液:K+、NO3—、Cl-、NH4+
D.含有大量OH—的无色溶液中:Na+、Cu2+、AlO2—、SiO32—
11.下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
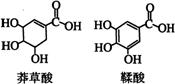 12.莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
12.莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
A.两种酸都能与溴水反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量相同
13.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mo1·L-1 HCOOH溶液中:c(HCOO—)+c(OH—)=c(H+)
B.1 L 0.1 mo1·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c(OH—)
C.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
D.0.1 mo1·L-1 Na2CO3溶液中:
c(H+)+c(HCO3—)+2c(H2CO3)=c(OH—)
 14.向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g)
14.向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g)![]() xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示:
下列说法正确的是
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
第Ⅱ卷 (非选择题 共72分)
三、(本题包括1小题,共12分)
15.(12分)二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
① 将干燥的氯气在110℃~140℃与硫反应,即可得S2C12粗品。
② 有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S; 300℃以上完全分解; S2Cl2+Cl2 |
设计实验装置图如下:
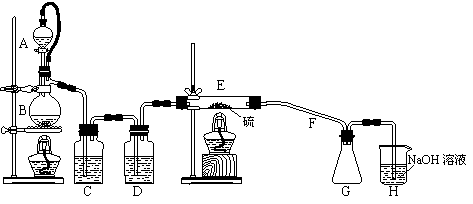
⑴ 上图中尾气处理装置不够完善,请你提出改进意见___________________________。
利用改进后的正确装置进行实验,请回答下列问题:
⑵ B中反应的离子方程式:_____________________________________________。
⑶ 仪器A的名称是__________________;装置C中的试剂是___________________;
玻璃管F的作用是_________________________________。
⑷ S2Cl2粗品中可能混有SCl2、S等杂质,为了提高S2Cl2的纯度,关键的操作是控制好温度和___________________________________。
四、(本题包括2小题,共18分)
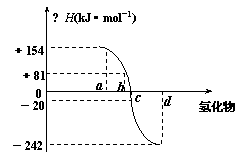 16.(6分)已知:在298K、1.01×105Pa下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。下图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
16.(6分)已知:在298K、1.01×105Pa下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。下图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
⑴ 写出氧族元素中含有18e-的两种氢化物的电 子式____________________。
⑵ 请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系____________________
_____________________________。
⑶ 硒化氢在上述条件下发生分解反应的热化学反应方程式为:________________________。
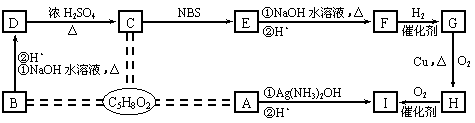
17.(12分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属;D是红色固体,K是一种红棕色气体;C、J都是常见的化工产品,且属于同一类物质。反应⑦为置换反应,反应⑩中物质G过量。
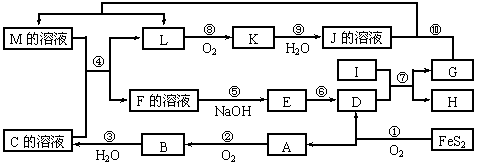 |
请填写下列空白:
⑴ 组成单质G的元素在周期表中的位置是_________________________。
⑵ 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
⑶ 在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
⑷ 反应⑨的化学方程式为_______________________________________。
⑸ 在反应⑩中,若反应消耗了1mol单质G,则转移电子总数为_________________;反应④的离子方程式是_______________________________________。
五、(本题包括1小题,共10分)
18.(10分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
⑴ 将尾气通人氨水中,能发生多个反应,写出其中可能发生的一个氧化还原反应的化学方程式:_____________________________________。
⑵ 在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
① 导致溶液温度降低的原因可能是__________________________;
② 析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为__________________________;
③ 生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是__________________________________。
⑶ 能用于测定硫酸尾气中SO2含量的是___________________。(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
六、(本题包括1小题,共12分)
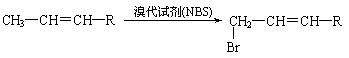 19.(12分)有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如题28图所示,已知:A的碳链无支链,且1 mol A 能与4 mol Ag(NH3)2OH完全反应;B为五元环酯。
19.(12分)有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如题28图所示,已知:A的碳链无支链,且1 mol A 能与4 mol Ag(NH3)2OH完全反应;B为五元环酯。
提示:
⑴ A中所含官能团是________________________________。
⑵ B、H结构简式为________________________________。
⑶ 写出下列反应方程式(有机物用结构简式表示)
D→C________________________________________________________;
E→F(只写①条件下的反应)____________________________________________。
⑷ F的加聚产物的结构简式为____________________________________________。
七、(本题包括1小题,共8分)
20.(8分)化合物KxFe(C2O4)y·zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491 g两份,其中一份在110℃干燥脱水,至质量恒定为0.437 g。另一份置于锥形瓶中,加入足量的3 mol·L—1 H2SO4和适量的蒸馏水,加热至75℃,趁热加入0.0500 mol·L—1 KMnO4溶液24.0 mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0 mL 0.0500 mol·L—1KMnO4溶液完全反应。
通过计算,分别求:
⑴ 0.491g样品中结晶水的物质的量。
⑵ 化合物中草酸根的质量分数。
⑶ 化合物的化学式。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
八、(本题包括1小题,共12分)
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21.(12分)
(A)【物质结构与性质】
请完成下列各题:
⑴ 前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
⑵ 第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为_______________________。在GaN晶体中,每个Ga原子与_________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为_________。在四大晶体类型中,GaN属于_________晶体。
⑶ 在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是____________________(填化学式)。
(B)【实验化学】
茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450多种有机成分与15种以上元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了如下探究实验方案:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500克干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L—1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.1000 mol·L—1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL,计算结果。
请回答下列问题:
⑴ 步骤 1中,使茶叶灰化需要三角架、泥三角、酒精喷灯、坩埚钳、____________等仪器。
⑵ 步骤2中,改用试剂________________来调节pH将更为妥当;判断沉淀已经洗涤干净的方法是______________________________________________________。
⑶ 步骤3中,滴定操作时,眼睛注视________________________________________。原茶叶中钙离子的质量分数为_____________________。若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,则测得的钙离子的质量分数将__________________(填序号)
①偏小 ②偏大 ③不偏 ④偏小或偏大或不偏
参考答案
一、单项选择题:本题包括8小题,每小题3分,共计24分。每小题只有一个选项符合题意。
1.D 2.C 3.C 4.A 5.B 6.A 7.B 8.D
二、不定项选择题:本题包括8小题,每小题4分,共计32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。
9.AC 10.B 11.BC 12.AD 13.C 14.D
三、(本题包括1小题,共12分)
15.(12分)⑴ 在G和H之间增加干燥装置
⑵ MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
⑶ 分液漏斗 饱和食盐水(或水) 导气、冷凝
⑷ 控制浓盐酸的滴速不要过快
四、(本题包括2小题,共18分)
16.(6分)⑴ ![]()
⑵ 非金属元素氢化物越稳定,△H越小,反之亦然
⑶ H2Se(g)=Se(s)+H2(g) △H=-81kJ·mol—1
17.(12分)⑴ 第四周期、第Ⅷ族
⑵ l∶2
⑶ ③
⑷ 3NO2+H2O=2HNO3+NO
⑸ 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
五、(本题包括1小题,共10分)
18.(10分)⑴ 2H2SO3+O2=2H2SO4 2(NH4)2SO3+O2=2(NH4)2SO4
2NH4HSO3+O2=2NH4HSO4(任填一个)
⑵ ①反应吸热
②(NH4)2SO3·H2O
③防止亚硫酸铵被氧化
⑶ BC
六、(本题包括1小题,共12分)
19.(12分)![]() ⑴ 醛基或—CHO
⑴ 醛基或—CHO
⑵ OHCCH2CH2CH2COOH
⑶ CH3CH(OH)CH2CH2COOH![]() CH3CH=CHCH2COOH+H2O
CH3CH=CHCH2COOH+H2O
BrCH2CH=CHCH2COOH+2NaOH![]() HOCH2CH=CHCH2COONa+NaBr+H2O
HOCH2CH=CHCH2COONa+NaBr+H2O
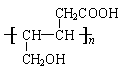 ⑷
⑷
七、(本题包括1小题,共8分)
20.(8分)⑴ n(H2O)==0.00300 mol
⑵ n(C2O42—)=0.0500 mol/L×0.024 L×2.5=0.00300 mol
m(C2O42—)=0.00300 mol×88 g/mol=0,264 g
w(C2O42—)=×100%=53.8%
⑶ 因为n(Fe3+)=n(Fe2+)=0.0500 mol/L×0.004 L×2=0.00100 mol
1∶y∶z=0.00100 mol∶0.00300 mol∶0.00300 mol=1∶3∶3
y=3,z=3
根据电荷平衡有:x+3=2y,得x=3
所以,化合物的化学式为:K3Fe(C2O42—)3·3H2O
八、(本题包括1小题,共12分)
21.(12分)
(A)【物质结构与性质】
⑴ 5
⑵ 1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1) 正四面体型 原子
⑶ 三角锥型 HClO和NH3·H2O
(B)【实验化学】
17.⑴ 坩埚
⑵ 氨水
取最后一次洗涤液少许于试管中,滴加CaCl2溶液,若无沉淀产生,则已洗净。
⑶ 锥形瓶内溶液颜色变化和滴定管内液体流出速率。
0.4%(或0.004)
④