2008届高三化学第一次模拟考试试题
考生注意:
1、答第Ⅰ卷前。考生务必在答题卡上用钢笔或圆珠笔清楚填写姓名、准考证号,并用铅笔正确涂写准考证号。
2、第Ⅰ卷(1~18题),由机器阅卷,答案必须全部涂写在答题纸上。考生应将代表正确答案的小方格用铅笔涂黑。注意试题题号和答题纸编号一一对应,不能错位。答案需要更改时,必须将原选项用橡皮擦去,重新选择。答案不能写在试卷上,写在试卷上一律不给分。
相对原子质量:H-1 C-12 O-16 N-14 Na-23 Cl-35.5 K-39 S-32 Ar-40 F-19
第Ⅰ卷(选择题,共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个正确选项符合题意。)
![]()
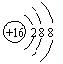 1、下列表达方式错误的是
1、下列表达方式错误的是
A、氯化氢分子的电子式:H+ [: :]- B、S2-的结构示意图:
C、O—18的原子符号:![]() D、CO2分子的结构式:O=C=O
D、CO2分子的结构式:O=C=O
2、在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A、CH3OH(l)+![]() O2(g)
O2(g) CO2(g)+2H2O(l);△H=+725.8 kJ/mol
B、2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-1452 kJ/mol
C、2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-725.8 kJ/mol
D、2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=+1452 kJ/mol
3、科学家最近发现2种粒子:第1种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子是氧元素的另一种同位素 D、第2种粒子的化学式为O4
4、下列取代基或微粒中,碳原子不满足最外层为8电子结构的是
A、一氯甲烷(CH3Cl) B、碳正离子(CH3+)
C、碳负离子(CH3—) D、二氧化碳(CO2)
5、同温同压下,下列各组气体具相等分子数、原子数和质子数的是
A、等质量的氧气与臭氧 B、等体积的氮气与一氧化碳
C、等体积的氯化氢与硫化氢 D、等物质的量的氟气与氩气
6、我们生活的地球只有一个,而它在遭到人为破坏,环境保护提上日程。下列有关环境问题的叙述正确的是
A、赤潮、白色污染、绿色食品都与相关物质颜色有关
B、我国的淡水资源短缺,故鼓励大量开采地下水,以满足社会需求
C、现代研制的油漆中一般不使用甲醛、酚类等化合物,因为这些化合物对人
体有毒
D、我国禁止汽车使用含铅汽油,其主要原因铅资源短缺
7、某溶液中存在较多的K+、H+、I-,下列离子可以在上述溶液中大量共存的是
A、Cl-、NH4+、Na+ B、H3O+、Cl-、NO3-
C、Na+、HCO3-、SO42- D、HCOO-、Br-、NH4+
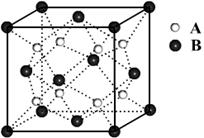
8、某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
A、B2A B、BA2
C、B7A4 D、B4A7
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性的强弱顺序是Cl-< Fe2+<H2O2< I-<SO2 ,则下列反应中不能发生的是
A、2Fe3++SO2+2H2O 2Fe2++SO42-+4H+
B、SO2+I2+2H2O H2SO4+2HI
C、H2O2+H2SO4
SO2↑+O2↑+2H2O
D、2Fe2++Cl2 2Fe3++2Cl-
10、月球中的每百吨32He聚变所释放出的能量相当于目前人类一年消耗的能量;地球上氦元素主要以42He的形式存在。已知一个12C原子的质量为a g,一个32He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是
A、32He比42He多一个中子
B、氦元素的近似相对原子质量为3
C、32He的相对原子质量为![]()
D、32He的摩尔质量为b NA g·mol-1
![]()
![]()
![]() 11、在实验室进行物质制备,下列从原样及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
11、在实验室进行物质制备,下列从原样及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
![]()
![]() A、C
CO
CO2
Na2CO3
A、C
CO
CO2
Na2CO3
![]()
![]() B、Cu
Cu(NO3)2溶液
Cu(OH)2
B、Cu
Cu(NO3)2溶液
Cu(OH)2
![]()
![]() C、Fe
Fe2O3
Fe2(SO4)3溶液
C、Fe
Fe2O3
Fe2(SO4)3溶液
D、CaO Ca(OH)2溶液 NaOH溶液
12、阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A、标准状况下,1 mol SO3所占的体积约为22.4 L
B、常温常压下,12 g Mg在空气中完全燃烧生成MgO和Mg3N2时转移电子数
约为6.02×1023个
C、25℃时,1 L pH=1的稀硫酸中约含2×6.02×1022个H+
D、12 g 石墨中含C-C键的数目约是1.5×6.02×1023
13、下列离子方程式正确的是
|
B、电解氯化镁:2Cl—+2H2O H2↑+C12↑+2OH—
C、Na2S溶于水:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D、铜片溶于稀硝酸:Cu+NO3-+4H+ Cu2++NO↑+2H2O
14、20℃时饱和KCl溶液的密度为1.174 g/cm3,物质的量浓度为4.0 mol/L,则下列说法中不正确的是
A、25℃时,饱和KCl溶液的浓度大于4.0 mol/L
B、此溶液中KCl的质量分数为![]()
C、20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D、将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g/cm3
15、下列说法正确的是
A、离子半径:Ca+<S2-,原子半径:Na>Cl
B、从上到下,卤素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C、因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D、钠在反应中失去的电子比铝少,故钠的金属性小于铝的金属性
16、已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
A、c(K+)+c(H+)=c(HSO3—)+c(OH—)+c(SO32-)
B、c(HSO3—)+c(SO32-)=0.1 mol·L-1
C、c(SO32-)>c(H2SO3)
D、c(K+)=c(H2SO3)+c(HSO3-)+c(SO32-)
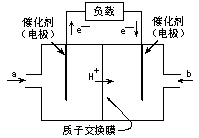
17、右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:
2CH3OH+3O2 2CO2+4H2O
下列说法正确的是:
A、右电极为电池的正极,b处通入的物质是空气
B、左电极为电池的负极,a处通入的物质是空气
C、负极反应式为:CH3OH+H2O-6e- CO2+6H+
D、正极反应式为:O2+4e- 2O2-
18、在容积不变的密闭容器中存在如下反应:
2SO2(g)+O2(g)![]() 2SO3(g);△H<0
2SO3(g);△H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:
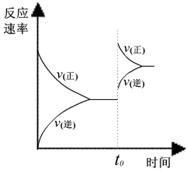
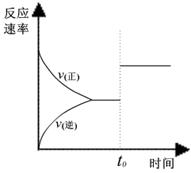
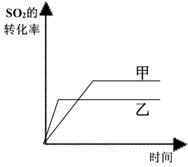
I II III
A、图I研究的是t0时刻增大O2的浓度对反应速率的影响
B、图II研究的是t0时刻加入催化剂后对反应速率的影响
C、图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D、图III研究的是温度对化学平衡的影响,且乙的温度较高
第Ⅱ卷(非选择题,共76分)
三、(本题包括2小题,共 分)
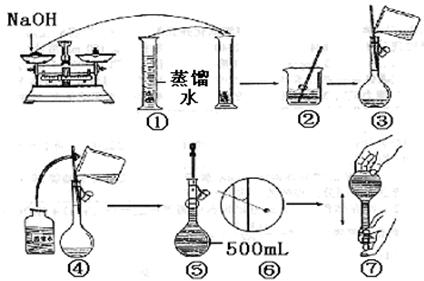
19、(1)、指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):
②容量瓶:
(2)、某学生用已知质量y g的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,下面他的正确操作应该是:
使 。
若称取的w g NaOH刚好可配制0.5 mol· L-1NaOH溶液500 mL。在下列配制0.5 mol·L-1 NaOH溶液过程示意图中有错误的是(填操作序号) 。
20、为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先出去其中的空气。其中第一步实验操作为:__________________________________________
如何确定E中空气已被赶尽:______________________________________
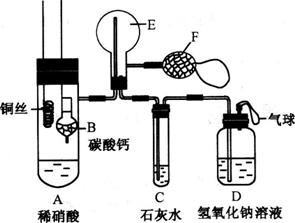
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________________________
一段时间后,C中白色沉淀溶解,其原因是_________________________________
______________________________________________________________________
(4)装置D的作用是___________________________________________________
四、(本题包括2小题,共 分)
21、已知过量氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量b mol。
①写出该反应配平的化学方程式:
②该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为
③阿伏加德罗数常数为(用含a、b的代数式表示)
22、已知X、Y、Z、L、M、N是元素周期中前20号的五种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物D。试回答:
(1)、X单质和Z单质在一定条件下可生成化合物E。
①、E的电子式为 ,化学键类型为 ,晶体类型为
②、工业上制取E的化学方程式为(注明反应条件)
______________________________________________________________________
③、实验室制取E的化学方程式为
(2)、由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是(用离子方程式表示)___________________________
若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是___________________
原因是(用离子方程式表示)______________________________________
(3)、NY2与水反应生成Y2X2和化合物D的化学方程式为:
______________________________________________________________________
五、(本题包括2小题,共 分)
23、已知:A是FeSO4,G是硫酸铁,且C和D,F和H元素组成相同。反应过程中产生的水在图示中已略去。
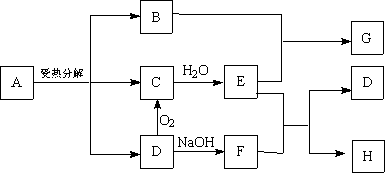
回答下列问题:
(1)A受热分解的化学方程式为:____________________________________
(2)检验F中所含阴离子的方法是:_____________________________________
(3)B跟E的稀溶液反应的离子方程式是:_______________________________
24、已知物质A显酸性,请根据以下框图回答问题:
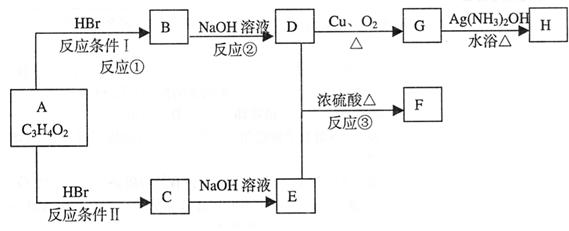 F为七原子组成的环状结构。
F为七原子组成的环状结构。
(1)A的结构简式为
(2)①②③的反应类型分别为 、 、
(3)化合物B中含有官能团的名称是
(4)D和E生成F的化学方程式
(5)G生成H的化学方程式
(6)写出C的同分异构体中属于酯类物质的结构简式:(任写2种)
________________________、_________________________
六、(本题包括2小题,共 分)
25、某温度下,KNO3不饱和溶液100 g,现将其溶液蒸发掉50 g H2O,析出晶体2.5 g,所得溶液的质量分数为20%。
(1)求该温度下KNO3的溶解度;
(2)求原不饱和溶液的质量分数;
(3)若原不饱和溶液的密度为ρg·cm-3,求原不饱和溶液的物质的量浓度;
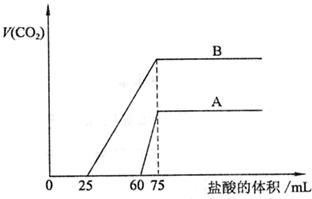 26、取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
26、取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)_________________,两种溶质的物质的量之比为__________;加盐酸后产生CO2体积的最大值为______________mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)_________________,两种溶质的物质的量之比为___________;加盐酸后产生CO2体积最大值__________mL。
(3)通过计算,求出原NaOH溶液的物质的量浓度。(简要写出计算过程)
高三化 学 试 题 答 案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 答案 | A | B | C | B | B | C | A | B | |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| C | CD | D | BD | A | D | A | CD | AC | BD |
19、(1)、①用蒸馏水湿润②检漏
(2)、继续向表面皿中加适量NaOH固体,指针指向中央 ①③⑥
20、(1)将装CaCO3的干燥管下移与稀HNO3反应产生CO2;当C处出现白色沉淀时
(2)3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O
(3)用F向E中鼓入空气,E内颜色加深;NO2进入C生成HNO3使CaCO3溶解
(4)吸收过量的NO2,防止空气污染
![]() 21、①8NH3+3Cl2
21、①8NH3+3Cl2 N2+6NH4Cl ②3:2 ③![]() mol-1
mol-1
|
| |||
| |||
②N2+3H2![]() 2NH3 ③Ca(OH)2+2NH4Cl
2NH3 ③Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
(2)CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
|
23、(1)2FeSO4 Fe2O3+SO2↑+SO3↑(2)取试样加足量H2SO4,产生气体通入品红,若品红褪色说明为SO32-。(3)Fe2O3+6H+
2Fe3++3H2O
24、(1)CH2=CH-COOH (2)加成、水解(取代)、酯化 (3)羧基
![]()
![]()
|
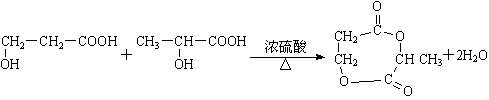
![]()
|
(6)H-C-O-CH-CH3、CH3-C-O-CH-Br(或其它合理答案)
25、(1)S=25 g(2)100-50-2.5=47.5g,w(KNO3)=![]() ×100%=12%
×100%=12%
(3)c(KNO3)=![]() mol/L=
mol/L=![]() mol/L
mol/L
26、(1)NaOH、Na2CO3 3∶1 33.6 (2)Na2CO3、NaHCO3 1∶1 112
(3)解:图示表明,向溶液中滴加0.1 mol/L的盐酸至不再放出CO2气体时,消耗盐酸的体积为75 mL。所以原NaOH溶液的物质的量浓度为:
![]() (其它合理解法可得分)
(其它合理解法可得分)