08届高三化学第一轮复习单元测试试卷
(物质的组成、分类和变化 氧化还原反应 离子反应 物质的量)
时间:120分钟 总分:150分 命题:47中毛艳滨
第一部分 选择题 (共105分)
一、选择题(每小题只有一个正确选项,请将正确选项的序号填写在答题纸上;每小题3分,共45分)
1.实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是
A.1000mL,212g B.950mL,543.4g C.任意规格,572g D.500mL,286g
2.下列有关物理量相应的单位表达错误的是
A.摩尔质量g/mol B.气体摩尔体积L/mol
C.溶解度g/100g D.密度g/cm3
3.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A.2.24 L CO2中含有的原子数为0.3×6.02×1023
B.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023
4.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
5.下列家庭小实验中不涉及化学变化的是
A.用熟苹果催熟青香蕉 B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制成甜酒酿 D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
6、物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是
A.①③ B.③④ C.①② D.①③④
7.在pH = 1时,可大量共存的无色溶液的一组离子或分子是
A.Ca2+、CH3COOH、Br-、Na+ B.NO3- 、Fe3+、Mg2+、SO42 -
C.ClO3-、Ba2+、Na+ 、Cl- D.K+、Cl-、Al3+、SO32 -
8.下列离子方程式书写正确的是
A.过量的SO2通入NaOH溶液中:SO2+2OH- = SO32 -+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- = 2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2- +6H+ = 2Mn2++5NO3- +3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- +Ba2++2OH- = BaCO3↓+2H2O+CO32 -
9、下列描述中,符合化学科学的是
A、“曾青得铁则化为铜”中的“曾青”是指硝酸铜
B、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
C、“玉不琢不成器”、“百炼方能成钢”的说法都与物质的化学变化无关
D、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂
10.用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏高的是
A.在烧杯中溶解时,有少量液体溅出
B.定容后,轻轻振荡、摇匀、静置,液面下降再加水至刻度
C.容量瓶使用前未干燥 D.定容时俯视容量瓶刻度线
11.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HCHO溶液(石蕊试液)
12.设NA为阿伏加德罗常数,下列叙述中正确的是
A.常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个
B.14 g乙烯和丙烯的混合物中总原子数为3NA个
C.0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D.5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个
13.下列叙述中正确的是
A.相同条件下,N2和O3混合气与等体积的N2所含原子数相等
B.等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16g CH4与18 g NH4+ 所含质子数相等
14.下列反应的离子方程式书写正确的是
A.浓烧碱溶液中加入铝片:Al+2OH- = AlO2- +H2↑
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+ = 2Fe3++2H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42 -+Ba2++2OH- = BaSO4↓+2H2O
15.向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离于组是
A.K+、Br-、CO32 - B.Al3+、H+、MnO4-
C.NH4+、Fe3+、SO42 - D.Ag+、Cu2+、NO3-
二、不定项选择题(本题包括15小题,每小题4分,共60分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
16.下列叙述正确的是
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
17.a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
A.1:7 B.7:1 C.7:8 D.8:7
18.能正确表示下列反应的离子方程式是
A.醋酸钠的水解反应:CH3COO-+H3O+= CH3COOH+H2O
B.碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3- +2OH- = CaCO3↓+2H2O+CO32 -
C.苯酚钠溶液与二氧化碳反应:C6H5O-+CO2+H2O = C6H5OH+CO32 -
D.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3- = 3Fe3++2NO↑+4H2O
19.往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量m(沉淀)与加入AgNO3溶液体积V(AgNO3)的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为
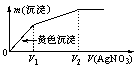
A.(V2-V1)/V1 B.V1/V2 C.V1/(V2-V1) D.V2/V1
20.在由水电离产生的H+浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3- 、S2-; ②K+、Fe2+、I-、SO42 -; ③Na+、Cl-、NO3- 、SO42 -
④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
21.a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸中恰好反应,产生NO气体,所得澄清溶液是Fe(NO3)3、H2SO4的混合液,反应中被还原的硝酸可能为
A.(a+b)×63g B.(a+b)mol C.(![]() )mol
D.(V×c-3a-3b)×63g
)mol
D.(V×c-3a-3b)×63g
22、下列各组离子在指定的环境中能大量存在的是
A、在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl-
B、在能使石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32-
C、在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3-
D、由水电离出的[H+]=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3-
23.M(NO3)2热分解化学方程式为:2 M(NO3)2![]() 2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
A.64g/mol B.24g/mol C.65g/mol D.40g/mol
24. 一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 。
则下列叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物 B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
25.对于反应①KHCO3溶液与石灰水反应;②Na2SO3溶液与稀盐酸反应;③Si与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量,不能用同一个离子方程式表示的是
A.①②③ B.①②④ C.①③④ D.②③④
26.5.12克铜和一定质量的硝酸反应,当铜消耗完时,共收集到标准状况下的气体3.36升,若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下的氧气才能使集气瓶充满溶液。
A 0.336升 B 0.224升 C 0.896升 D 1.12升
27.密度为0.910g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为
A.等于13.5% B.大于12.5% C.小于12.5% D.无法确定
28.将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A.![]() B.
B.![]()
C.![]() D.100VρM/(MV+2240)
D.100VρM/(MV+2240)
29、NA表示阿佛加德罗常数。下列说法中正确的是
A、200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
B.1molCH4分子中共价键总数为4NA
C、标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
D、S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
30.t℃时,将100 g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5 g晶体;再蒸发掉10 g水,恢复至t℃,析出7.5 g晶体。下列说法中正确的是
A.t℃时原溶液是饱和溶液 B.t℃时A的溶解度为75 g
C.若A是CuSO4,则7.5 g晶体中含水2.7 g D.原溶液中A的质量分数为40%
第二部分 非选择题 (共45分)
三、填空题(本小题包括3小题,共33分)
31.(13分)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
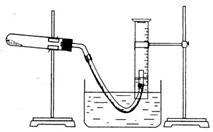
回答下列问题:
(1)如何检查装置的气密性?____________________________________________ 。
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:___________________(请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
___________________________________________________________
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×l05 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)= __________________________________________。
|
32.(8分)抗击“非典”期间,过氧乙酸( )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4-+□H2O2+□H+===□Mn2++□O2十□H2O
② H2O2+2![]() +2H+===I2+2H2O
+2H+===I2+2H2O
|
③
+2![]() +2H+===CH3COOH+I2+H2O
+2H+===CH3COOH+I2+H2O
④ I2 + 2S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
MnO4-+ H2O2+ H+ === Mn2++ O2十 H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是___________________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·![]() 的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
另取b0
mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成
I2(反应②和③)。再用浓度为a2 mol·![]() 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ___________ 。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
33、(12分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
五、计算题(12分)
34. (12分) 6.4克铜与过量硝酸(a mol/L ,30mL)充分反应,硝酸的还原产物只有NO2、NO,反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol
(2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | A | C | D | D | D | A | A | C | B | D | A | B | B | C | A |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | B | B | B | C | B | CD | B | B | B | B | C | C | B | BD | C |
31(13分)答案:(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(2)②①③ (3)慢慢将量筒下移 (4)![]()
32.(8分)答案:(1) 2 5 6 2
5 8 (2)淀粉溶液 (3)![]() (4)否
(4)否
33、(12分)
(1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O
(2)酸性 氧化性
(3)0.6mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
34.(12分)
⑴ 0.3 (6分)
⑵ n(NO)= 0.045a-0.55 n(NO2)=0.025-0.015a