08届高三化学第二学期考前复习试卷
化 学 试 卷(三)
YCY
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.考试时间90分钟,满分100分.
可能用到的原子量:H=1 O=16 S=32 Na=23 Fe=56 Cl=35.5 Cu=64
第Ⅰ卷(选择题,共20题,共50分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。)
1.闪电时空气中有臭氧生成,下列说法正确的是 ( )
A.O2和O3互为同位素 B.O2比O3稳定
C.等体积的O2和O3具有相同的质子数D.O2与O3的相互转变是物理变化
2.下列化学式既能表示物质的组成,又能表示物质的一个分子的是 ( )
A.NaOH B.C C.SiO2 D.CO2
3.下列物质属于弱电解质的是 ( ) A.氯化铝 B.铜 C.酒精 D.水
4.实现下列各组物质的变化时,需克服的作用力完全相同的是 ( )
A.硫磺和氢氧化钠的熔化 B.二氧化硅和生石灰的熔化
C.碘和萘的升华 D.氯化钠和铁的熔化
5.下列含有非极性键的共价化合物是 ( )
A.HCl B.Na2O2 C.C2H2 D.CH4
|
C.2Na+2H2O==2NaOH+H2↑ D.Cl2+H2O==HCl+HClO
7.按金属活动性顺序由前到后考虑,下列说法中正确的是 ( )
A.单质的还原性逐渐减弱 B.原子的失电子能力逐渐增强
C.对应离子的氧化性逐渐减弱 D.金属原子失电子越多,还原性越强
8.在氧化还原反应中,下列叙述正确的是 ( )
A.氧化剂本身被还原,生成氧化产物
B.物质在变化中失去电子,此物质是氧化剂
C.发生电子转移的反应即是氧化还原反应
D.还原剂在反应时所含元素的化合价降低
9.下列反应中生成物总能量高于反应物总能量的是 ( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
10.用石墨作电极,电解1mol·L-1下列物质的溶液,溶液的pH保持不变的是 ( )
A.HCl B.KOH C.NaNO3 D.CuSO4
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
11.下列事实与胶体知识有关的是 ( )
①用盐卤点豆腐;②用明矾净水;③河海交接处易形成沙洲;
④一束平行光照射蛋白质溶液时,从侧面可以看到光亮的通路;
⑤一支钢笔使用不同牌号的蓝黑墨水易出现堵塞;
A.①②⑤ B.①③④⑤ C.①②③④⑤ D.全部都无关
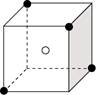 12.某离子晶体结构如图所示,X(●表示)位于立方体的顶点,Y(○表示)位于立方体的中心。该晶体的化学式应为 ( )
12.某离子晶体结构如图所示,X(●表示)位于立方体的顶点,Y(○表示)位于立方体的中心。该晶体的化学式应为 ( )
A.XY2 B.X2Y
C.X4Y D.XY3
13.下列各组物质中,熔点由高到低的是 ( )
A.HI.、HBr、HCl、HF
B.石英、食盐、干冰、钾
C.CI4、CBr4、CCl4、CF4
D.Rb、K、Na、Li
14.下列各组离子在指定条件下,—定能大量共存的是 ( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3-
B.c(H+)=10—1mol/L的溶液中:Cu2+、Al3+、SO42—、NO3—
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D.水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
15.下列实验室制备有关物质的方法中,合理又实用的是 ( )
A.用含少量Cu2+的稀硫酸和锌粒反应制氢气
B.煅烧石灰石制备二氧化碳
C.用NH4Cl溶液和Ca(OH) 2溶液反应制氨气
D.用FeCl3溶液和NaOH溶液反应制Fe(OH) 3胶体
16.水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是 ( )
A.1L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.18g水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH
D.该水蒸气冷凝后,测氢.氧原子个数比
17.用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
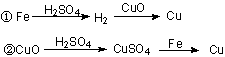
若按实验原则进行操作,则两者制得单质铜的量为 ( )
A.一样多 B.①多 C.②多 D.无法判断
18.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol 氢气中的化学键消耗的能量为Q1 KJ,破坏1mol氯气中的化学键消耗的能量为Q2 KJ,形成1mol HCl中的化学键释放的能量为Q3 KJ。则下列关系中正确的是 ( )
A.Q1 + Q2 =Q3 B. Q1 + Q2 >2Q3
C.Q1 + Q2 <Q3 D.Q1 + Q2 <2Q3
19.下列反应的离子方程式正确的是 ( )
A.铁和稀硝酸反应 Fe+2H+===Fe2++H2↑
B.电解饱和食盐水 2Cl—+2H+![]() H2↑+C12↑
H2↑+C12↑
C.向溴化亚铁溶液中通入过量的氯气![]() 2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
D.向偏铝酸钠溶液中加入少量的NaHSO4溶液 AlO2- + H+ + H2O === Al(OH)3 ↓
20.关于氢键,下列说法正确的是 ( )
A.分子间形成的氢键使物质的熔点和沸点升高
B.冰中存在氢键,水中不存在氢键
C.每一个水分子内含有两个氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
第Ⅱ卷(非选择题,共7 题,共50分)
21.(3分)对某酸性溶液(可能含有Br-、SO42-、H2SO3、.NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略显橙黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
不能确认其在原溶液中是否存在的离子是 。
22.(9分)(1)测定HCl和NaOH反应的中和热时,每次实验均应测量三个温度是:
① ② ③ 。
(2)由“C(石墨)== C(金刚石);△H= +119 kJ/mol ”可知金刚石比石墨 (填“稳
定”或“不稳定”)
(3)在稀溶液中: H++OH-=H2O;放出热量57.3kJ,则稀硫酸与稀氢氧化钠溶液反应,
中和热的热化学方程式为: 。
(4)在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 。
23.(4分)有下列类卤分子及其相应的阴离子:(CN)2和CN-或(SCN)2和SCN-,性质类似于X2和X-,如Cl-的还原性比Br-弱,Br2的氧化性比(SCN)2强。在亚铁盐溶液中通入适量的氯气,再滴加KSCN溶液,溶液显___________色,而在KSCN溶液中先通入足量的氯气,再加入含有Fe3+的盐溶液,溶液不能显红色,这是因为__________________ 。
24.(8分)某无色溶液可能是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3、
(NH4)2 SO4溶液中的两种混合而成。取该溶液,向其中加入稀硫酸,有白色沉淀生成;继续加入稀硫酸,沉淀又完全消失,整个实验过程中无气体产生。
(1)原溶液是由 和 溶液混合而成的。
(2)从混合开始的整个实验过程中,有关反应的离子方程式是:
、 、
。
25.(6分)实验室用铜和硫酸制取CuSO4有几种方法:
甲学生进行了下列实验:取6.4g铜片和10mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶
中还有较多的硫酸剩余。他这样认为的理由是:
。
|
CuO+H2SO4 == CuSO4+H2O。对比甲的方案,乙同学的优点是:
;
为了同样达到乙同学的优点,你能不能根据电化学原理也设计一个用铜和稀硫酸制
取CuSO4的方案?(其它材料任选):
26.(10分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热浸泡一会,除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置.冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广囗瓶中,密封保存。
请回答下列问题:
(1)实验步骤①的目的是__________________ ,
加热的作用是___________________ _。
(2)实验步骤②明显不合理,理由是_______________________
。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_____________ 、
_______________ 。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O.FeSO4·4H2O
和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成,如下表
所示(仅在56.7℃.64℃温度下可同时析出两种晶体)。
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据,若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度
(t)的范围为_________ 。
27.(10分)化学工业在国民经济中占有极其重要的地位,硫酸是许多化学工业的原料。也是国家工业发达水平的一种标志。
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有____________(填序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(2)硫酸工业的尾气中含有少量的SO2,常用过量氨水吸收,写出该反应的离子方程式:
。
(3)如果将一定体积的尾气(不考虑三氧化硫)通入100mL3mol/L的NaOH溶液中使其完全反应,经低温.低压蒸得固体23.0克,通过计算确定所得固体物质的成分及其物质的量。
参考答案:
1.B 2.D 3.D 4.C 5.C 6.D 7.A 8.C 9.A 10.C
11.C 12.A 13.C 14.B 15.A 16.A 17.C 18.D 19.D 20.A
21.SO42-
22.(1)①盐酸起始温度 ②NaOH起始温度 ③反应后的终止温度
(2)不稳定
(3)1/2H2SO4(aq) + NaOH(aq) === 1/2Na2SO4(aq) + H2O(l):△H = —57.3kJ·mol-1,
(4)H2(g) + 1/2O2(g) = H2O(l);△H= -285.8kJ/mol
23.红 SCN-具有比Br-、Cl-更强的还原性,能被Cl2氧化成(SCN)2,因此在加入Fe3+ 时并无Fe(SCN)3形成,不能显红色
24.(1)NaOH, AlCl3
(2)Al3+ +4OH- ==== AlO2- +2H2O AlO2-+H+ +H2O==== Al(OH)3↓
Al(OH)3+3H+ ==== Al3+ +3H2O
25.随着反应进行,浓硫酸浓度逐渐变小,不能再与铜发生反应(2分)
乙消耗的硫酸的物质的量更少(1分)、不产生污染物SO2(1分)
以铜为阳极、碳(Fe.Pt)电极为阴极,电解硫酸溶液 (2分)
26.(1)除油污 升高温度,YC溶液碱性增强,去油污能力增强
(2)应该铁屑过量(或反应后溶液中必须铁有剩余),否则溶液中可能有Fe3+存在。
(3)洗涤除去晶体表面附着的硫酸等杂质,减少晶体的损失。
(4)56.7℃ ‹ t ‹ 64℃
27.(10分) ⑴CD (2分,少一个扣1分,少两个扣2分,多选.错选不得分)
⑵2NH3·H2O+SO2=2NH4+ +SO32- +H2O(2分)
⑶原NaOH的物质的量为:100×10-3L×3mol/L=0.3mol
当0.3molNaOH完全转化为NaHSO3时,质量为:0.3mol×104g/mol=31.2g
当0.3molNaOH完全转化为Na2SO3时,质量为:0.5×0.3mol×126g/mol=18.9g
现生成固体为23.0克,故生成物为Na2SO3 和NaHSO3的混合物(2¹)
设混合物中Na2SO3 和NaHSO3物质的量分别为x.y
2x+y=0.3① (1¹)
126x+104y=23② (1¹)
由①.②解得x=0.1mol, y=0.1mol (各1¹)