08届高三化学第二学期适应性练习
理科综合能力测试 2008.3
本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,第I卷1至6页,第II卷7至16页。满分300分。考试时间150分钟。
注意事项:1.答卷前将学校、班级、姓名填写清楚。
2.第I卷每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,第II卷各小题用钢笔或圆珠笔将答案直接写在试题卷上。
第I卷(选择题 共 120分)
本卷共20小题,每小题6分,共120分。在每小题的四个选项中,选出符合题目要求的一项。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24
S 32 Cl 35.5 Fe 56 I 127
5.下列说法正确的是
A.石油裂解可以得到聚乙烯
B.石油主要是由各种烷烃、环烷烃、芳香烃和炔烃组成的混合物
C.塑料、纤维、橡胶是通常所说的三大合成材料
D.向蛋白质溶液中加人饱和硫酸钠溶液可产生盐析现象
6.下列说法正确的是
A.同温同压下甲烷和氧气的密度之比为2:1
B.1g甲烷和1g氧气的原子数之比为 5:l
C.等物质的量的甲烷和氧气的质量之比为2:1
D.在标准状况下等质量的甲烷和氧气的体积之比为1:2
7.下列关于实验的说法正确的是
A.中和滴定开始时,装标准液的滴定管读数不一定是零点
B.中和滴定过程中,眼睛注视着滴定管中液面下降的情况
C.配制0.1mol/L的盐酸500 mL,选用的仪器有滴管、烧杯、玻璃棒、天平、容量瓶
D.测定硫酸铜晶体中结晶水含量,加热坩锅中晶体完全失水后,在空气中冷却,再称量
8.X、Y、Z和R为原子序数依次递增的四种元素。其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素。下列说法不正确的是
A.127R—的核外含有54个电子
B.Y、Z、R的氢化物的稳定性逐渐减弱
C.有lmolY的单质与水发生反应则转移电子的物质的量为2mol
D.在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色
9.下列说法正确的是
A.互为同分异构体的物质一定不是同系物
B.饱和一元所羧酸一定不能被酸性高锰酸钾溶液氧化
C.乙醇转化为乙醛的反应有碳氧双键生成,属于消去反应
D.苯酚与乙酸酐(![]() )生成乙酸苯酯的反应属于酯化反应
)生成乙酸苯酯的反应属于酯化反应
10.某溶液中存在Na+、SO42-、SO32-、Cl-、HCO3-、Br-中的若干种,依次进行下列实,观察到现象记录如下。
(1)用pH试纸检验,溶液的pH>7;
(2)向溶液中滴加新制氯水,无气体产生,加入四氯化碳振荡、静置,四氯化碳层呈橙色,
用分液漏斗分液;
(3)向分液后所得的水溶液中加入硝酸钡和稀硝酸的混合液,只有白色沉淀产生,过滤;
(4)在滤液中加入硝酸银和稀硝酸的混合液,有白色沉淀产生。
下列判断正确的是
①肯定有Na+ ②肯定有SO42- ③肯定有SO32-
④肯定有Br- ⑤肯定有Cl- ⑤肯定没有HCO3-
A.①③④⑥ B.①②④⑥ C.②③④⑥ D.③④⑤⑥
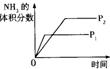
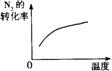
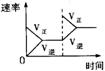
11.对于可逆反应N2(g)+3H2(g)![]() 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
12.室温下,一元酸HA溶液与一元碱BOH溶液等体积混合,下列有关判断正确的是
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱
C.若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足:
C(B+)>C(A-)>C(H+)>C(OH-)
25.(15分)某有机物A的分子式为C6H8O7,对其进行如下实验。
①将 1.92 g A与100 mL 0.3 mol/L碳酸氢钠溶液混合,恰好反应。
②在一定条件下,能与乙酸发生酯化反应。
请根据题目要求回答问题。
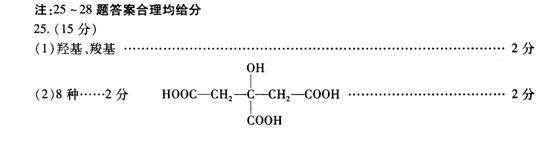
(1)推测A的分子结构中具有的官能团 (写名称)。
(2)若经测定A的结构中无甲基,则A可能的结构简式有 种。其中一种结构为柠檬酸,已知柠檬酸结构中相同的官能团不是连接在同一个碳原子上,且柠檬酸在铜催化条件下不会被氧化,则柠檬酸的结构简式为 。
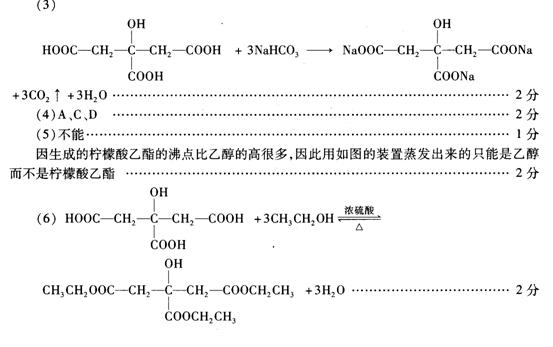
(3)写出柠檬酸与足量碳酸氢钠溶液反应的化学方程式 。
(4)在一定条件下柠檬酸可以发生化学反应的类型有 (填序号)。
A.取代反应 B.加成反应 C.消去反应 D.中和反应 E.加聚反应
(5)柠檬酸和部分有机物的熔沸点见下表
| 乙酸 | 乙醇 | 乙酸乙酯 | 柠檬酸晶体 | 柠檬酸乙酯(液体) | |
| 沸点(℃) | 118 | 78.5 | 77.1 | 294 | |
| 熔点(℃) | 153 | —55 |
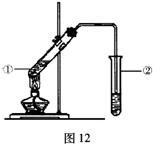 由数据分析柠檬酸与乙醇发生酯化反应,用如图12的装置,
由数据分析柠檬酸与乙醇发生酯化反应,用如图12的装置,
在试管②中,能否收集到柠檬酸乙酯(填“能”或“不能”),原因是 。
(6)写出柠檬酸与足量乙醇完全酯化反应的化学方程式
。
26.(15分)二氧化硫是污染大气形成酸雨的主要有害物质之一,如果了解二氧化硫的性质,它在我们的生活中也有广泛的用途。
(1)下列可产生二氧化硫污染大气的是 。(填序号)。
A.含硫矿石的冶炼 B.大量化石燃料的燃烧
C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
(2)某课外小组采集了一份雨水样品,每隔一段时间测定该雨水样品的pH变化数据如下
| 测试时间段 | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析雨水样品PH变化的原因(用文字和化学方程式说明)
。
(3)某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告。
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 |
| ① |
| ||
| ② | 氧化性 | ||
| ③ | 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
(4)目前,我国大都使用以亚硫酸类化合物为主的漂白剂,通过产生的二氧化硫而使食品漂白。我国《食品添加使用卫生标准》规定:“亚硫酸用于蜜饯、葡萄糖中的残留量(以二氧化硫计)不超过0.05 g/kg”。目前通常采用滴定法测定食品中残留二氧化硫的含量。具体实验方法主要是:样品经处理后,加入氢氧化钾使残留的二氧化硫以亚硫酸盐的形式固定,再加入硫酸使二氧化硫游离,用碘标准溶液滴定二氧化硫。在滴定时用 (填名称)作指示剂,滴定终点的现象是 。
(5)现有100 g二氧化硫含量超标的蜜饯样品经过处理后,配制成1000mL溶液,取出50 mL溶液,分别与氢氧化钾、硫酸反应,再用碘标准溶液 5![]() 103mol/L滴定,消耗碘标准溶液5 mL,则样品中二氧化硫的含量(g/kg)为
(保留二位小数)。
103mol/L滴定,消耗碘标准溶液5 mL,则样品中二氧化硫的含量(g/kg)为
(保留二位小数)。
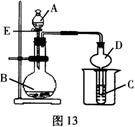 27.(l6分)某课外小组利用如图13装置进行相关实验,请回答下列问题。
27.(l6分)某课外小组利用如图13装置进行相关实验,请回答下列问题。
(1)仪器D在实验中的作用是 ,
实验前检查整套装置气密性的方法是
。
(2)若将A容器中的液体逐滴加人到B容器的固体中,产生气体,该气体可以是(填化学式,写出4种即可) 。
(3)若 A中装有浓盐酸,B中装有高锰酸钾固体,C容器中装有淀粉碘化钾溶液,旋开 E
后,一段时间C中溶液变蓝色,写出B中发生反应的化学方程式
;
(4)工业上用电解饱和氯化钠溶液的方法制取氯气,写出该反应的化学方程式
;电解过程中在阴极附近可得到(填名称),生成的原因是 ;
若电解池中装有 26.0%的氯化钠溶液 2.0 L(密度为1.2g/mL),当在标准状况下生成112.0L的氯气时(假设产生氯气全部放出),电解池溶液中氯化钠溶质的质量分数为 。
28.(14分)有X、Y、Z和W四种元素。已知:①X、Y、Z属同一短周期,其离子以X2+、
Y3+、Z-的形式存在。②W和Z组成化合物WZ3溶液遇苯酚呈紫色。请回答:
(1)Z的最高价氧化物对应水化物的名称为 。
(2)X的单质在M氧化碳中燃烧的化学方程式为 。
(3)Y的单质可用于冶炼金属锰,写出Y与二氧化锰反应的化学方程式 ,
Y的最高价氧化物对应的水化物既可溶于强酸又可溶于强碱,请用电离平衡理论解释其原因 。
(4)当有28.0 g W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下
的体积为 L。
(5)我国陆地上冶炼X的主要流程如图14所示
 |
已知当有 lmolX的氧化物参加反应时,有2 mol电子转移且生成三种产物,则步骤②反
应的化学方程式为 。
(6)在新生代的海水中有一种细菌,它们提取海水中W2+,利用酶为催化剂把W2+转化为它们的皮鞘(可用W2O3表示其中W);该反应中的另一种反应物二氧化碳转化为甲醛,请用离子方程式表示上述转化过程(W用具体元素符号表示) 。