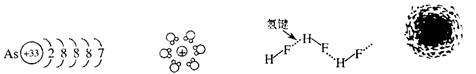08届高三化学第一学期统测试题
内容:基本概念、基本理论 命题:覃娇燕
(全卷共10页,仅供化学班使用)
可能用到的原子量:C 12 H 1 O 16 N 14 P 31 S 32 Na 23 Fe 56 Ba 137
第I卷 选择题 (共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.环境问题是2007年“两会”的重要议题,保护环境是公民的责任和义务。下列涉及
环保问题的说法正确的是( )
A.大量使用含磷洗涤剂会带来白色污染
B.减少使用氟氯代烷的目的是为了减少酸雨
C.大量开采地下水,矿产资源,以满足社会经济发展的需求
D.氢燃料电池汽车的使用,可以有效减少城市空气污染。
2.下列现象或应用不能用胶体知识解释的是 ( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
C.牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐有固体析出
D.水泥厂、冶金厂常用高压电除去工厂烟尘,减少对空气污染
3.用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确
的是( )
|
在通常状况下氢原子
砷原子结构示意简图 水合钠离子示意简图 HF分子间的氢键 电子云示意图
A B C D
4.绿色化学符合“又好又快”新的发展要求,下列生产过程体现绿色化学精神的是( )
A.联合制碱法 B.用氯气消毒自来水
C.以黄铁矿为原料冶炼金属铁 D.用工业酒精勾兑白酒
5.关于下列各装置图的叙述中,错误的是( )
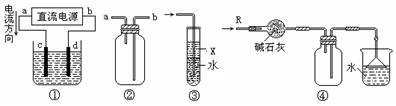
A.装置①中,c为阳极,d为阴极
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
6.设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.1molCl2与足量铁反应转移的电子数是3NA
B.1mol氧单质含有的原子数是1mol氖气含有的原子数的两倍
C.1mol金刚石含有的C—C键为 4 NA
D.标准状况下,11.2L NO与11.2L O2混合后所含分子数小于NA
7.一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:
2AtI+2Zn = ZnI2+ZnAt2 AtI+2NH3(1)= NH4I+NH2At 。则下列叙述正确的是( )
A ZnI2既是氧化产物,又是还原产物
B ZnAt2既是氧化产物,又是还原产物
C AtI与液氨反应,AtI既是氧化剂又是还原剂
D AtI与液氨反应,是自身氧化还原反应
8.下列叙述正确的是( )
A.碘在碘化钾溶液中溶解度显著增大,原因是发生氧化还原反应生成I3-
B.氯化铁溶液遇KSCN溶液显红色,原因是生成Fe(SCN)3沉淀
C.氢氟酸需保存在塑料瓶中,原因是氢氟酸具有强酸性而腐蚀玻璃
D.氯化银难溶于水而溶于氨水,原因是生成Ag(NH3)2Cl
9.下列叙述正确的是( )
A.同一主族的元素,原子半径越大,其单质的熔点越高
| |
C.位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元
素的最高化合价一定是X<Y
D.将pH=2,体积相同的盐酸和醋酸溶液均稀释100倍后,分别加入足量的相同颗粒大小的锌,产生H2的起始速率相同,醋酸放出的氢气多
10.右图是反应A2 +B2![]() 2AB 在不同温度和压强下,AB体积
2AB 在不同温度和压强下,AB体积
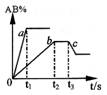 分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温
分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温
度时的变化情况,c 曲线在保持与b 相同温度时从时间t3 开
始增大压强的情况,则下列叙述正确的是( )
A.A2 、B2 、AB 均为气体,正反应放热
B.AB 为气体,A2 、B2 中最少有一种为非气体,正反应放热
C. AB 为气体,A2 、B2 中只有一种为非气体,正反应吸热
D.从时间t3开始到重新达到平衡这段时间内,体系内的气体平均摩尔质量一定发生变化。
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一至两个选项符合题意)
11.下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)=2H2O(l) △H =-571.6 kJ·mol—1,则氢气的燃烧热为285.8 kJ·mol—1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH
溶液反应的热化学方程式为:
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4 kJ·mol—1
D.己知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
12.下列各组比较项目包含的数据关系中,前者比后者大的是( )
A.氨水与氯水中微粒种数 B.NH4+离子与 P4分子中的键角
C.C2H2与 C6H6分子中碳碳键键长 D.H2O2与 O2分子中氧氧键键能
13.下列离子方程式正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
2 OH- + NH4+ + HCO3-== CO32-+ NH3·H2O + H2O
B.乙酸和氢氧化钠溶液混合:OH-+ CH3COOH = CH3COO- + H2O
C.次氯酸钠溶液和氯化亚铁溶液混合:
6 Fe2+ + 3 ClO- + 3 H2O == 2 Fe(OH)3↓ + 4 Fe3+ + 3 Cl-
D.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3 H+ = Fe3+ + 3 H2O
14.类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能决定其正确与否。以下几种类推结论中,不正确的是( )
A.金属镁失火不能用二氧化碳灭火器扑灭;金属钠失火也不能用二氧化碳灭火
B.浓硫酸具有强氧化性,可使铁钝化;浓硝酸也具有强氧化性,也能使铁钝化
C.C在自然界有稳定的单质存在;Si在自然界也有稳定的单质存在
D.Al在O2中燃烧,生成Al2O3,Fe在O2中燃烧生成Fe2O3
15.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH = CO2↑+ H2O+2CH3COO- | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| B | 苯酚钠溶液中通入 少量CO2 | C6H5O—+ CO2 + H2O → C6H5OH + HCO3— | 错误,通入少量CO2应生成CO32— |
| C | NaHCO3的水解 | HCO3-+H2O | 正确 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2+ + 2Br—+ 2Cl2 = 2Fe3+ + Br2 + 4Cl— | 正确 |
16.下列各组离子,在所给条件下一定能够大量共存的是( )
A.pH=0的溶液中:Fe3+、Mg2+、NO3-、SO42-
B.能和Ca2+生成沉淀的溶液中:K+、Ba2+、CH3COO-、Cl-
C.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2—、SO32—
D.由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl-
17.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6![]() CoO2+LiC6,下列说法正确的是( )
CoO2+LiC6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e- = Li++C6
B.放电时,电池的正极反应为CoO2+Li++e- = LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
18.等质量的三份铁a、b和c,分别加入稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COOK。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是
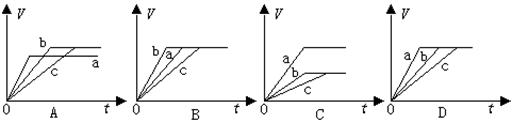
19..0.1mol/L NH3·H2O用水稀释后下列说法不正确的是
①电离程度增大 ②OH-离子数目增多 ③pH值增大 ④导电性增强
A 只有① B 只有② C ③和④ D ①和②
20.常温下,下列各溶液的叙述中正确的是( )
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
第II卷 非选择题(共80分)
三、(本题包括3小题,共 29分)
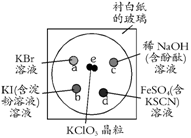 21(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
21(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,(1)试描述反应的现象,(2)写出e、d处相应的化学反应方程式,a、b、c处相应的离子反应方程式。
e处:现象
化学反应方程式
a处:现象
离子反应方程式
b处:现象
离子反应方程式
c处:现象
离子反应方程式
d处:现象
化学反应方程式
22(9分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是 。写出H2O2在二氧化锰作用下发生反应的化学方程式 。
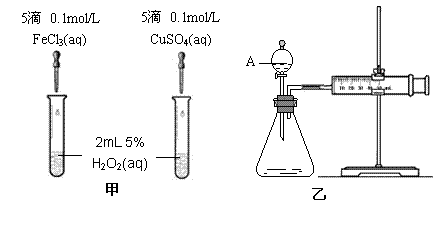 |
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
23(10分)
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度________________ (填“大于”、“等于“或“小于”)0.1 mol·L-l NaOH溶液中水的电离程度。若将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为___________________________________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H![]() +H2O N2H4+H2O
+H2O N2H4+H2O![]() N2H
N2H![]() +OH-
+OH-
N2H![]() +H2O
+H2O![]() N2H
N2H![]() +OH- N2H
+OH- N2H![]() + H2O
+ H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO ==_________NaCl+_______N2H4+_____ _____
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式
______________________。
四、(本题包括2小题,共 21分)
24(8分)工业上可利用反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ,生产合成氨原料气H2。
CO(g)+3H2(g) ,生产合成氨原料气H2。
已知温度、压强和水碳比[![]() ]对甲烷蒸气转化反应的影响如下图:
]对甲烷蒸气转化反应的影响如下图:
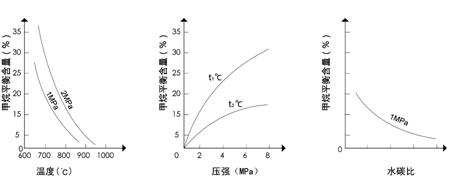
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
该反应平衡常数表达式为K=__________
(1)升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同)。
(2)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(3)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是__________
25(13分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高允许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其它还原性气体):
⑴ 测定原理: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,
化学反应离子方程式为: 4MnO4—+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4—+
|
|
|
![]()
![]()
|
|
⑶ 实验步骤:
① 检查装置气密性(气密性良好)。
② 用 (填仪器名称)准确移取25.00 mL 1.00×10-3mol·L—1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L—1H2SO4溶液备用。
③ 将2.00×10—3mol·L—1的草酸标准溶液置于 (填仪器名称)中备用。
④ 打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?
_________________________________________________________;
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将 (填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。
本实验是否需要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)。 。
⑦ 再重复实验2次。
⑷ 数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 25.00mL):
| 装修后 第n天 | 草酸溶液(mL) | 甲醛的浓度 mg/m3 | |||
| 1 | 2 | 3 | 平均值 | ||
| 1 | 15.86 | 15.72 | 15.67 | 15.75 | |
| 7 | 26.17 | 26.36 | 26.38 | 26.27 | |
| 30 | 30.90 | 30.67 | 30.81 | 30.79 | |
设KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为V1(mL);
草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为V2(mL)
则:计算室内空气中甲醛浓度(mg/m3)的代数式为 ,计算第30天室内空气中甲醛浓度为_____________(精确到小数点后二位),并判断此时主人________(填“能”或“否”)入住。
五、(本题包括2小题,共20分)
26(10分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式
__________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是_________________________________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________(填化学式)
27(10分)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
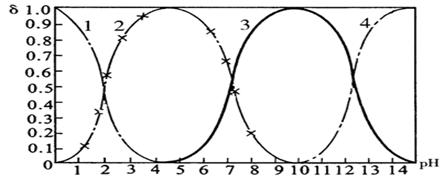 |
1表示H3PO4;2表示H2PO4-;3表示HPO42-;4表示PO43-
(1)设磷酸总浓度为c(总),写出c(总)与各含磷粒子浓度间的关系式
。
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是 。
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是
。
(4)在Na3PO4溶液中,c(Na+)/ c(PO43-) 3(填“>”、“=”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/ c(PO43-)的值减小,原因是 。
六、(本题包括1小题,共10分)
28(10)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大。A是非金属性最强的元素且A、D同主族;B、C、D同周期, B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水;E是第四周期主族元素。试回答:
(1)写出E原子的核外电子排布式
(2)A和D氢化物中,沸点较高的是 (填化学式);A、B、C、D的离子中,半径由大到小的顺序是 (填写离子符号)。
(3)元素C在元素周期表中的位置是第 周期, 族。元素C和D形成的化合物的晶体类型为 ,该化合物易形成二聚分子,其结构式为 ,C与D之间的成键方式为 ,中心C原子采用 杂化。
(4)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点和面心;阴离子均位于小正方体中心。该化合物是 (填写化学式)。
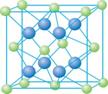
![]()
晶胞 晶胞的1/8
高三化学第一学期统测试题
参考答案
1-5 D、B、D、A、C; 6-10 D、B、D、B、C;
11-15 A、B、BC、CD、D; 16-20 A、B、AD、C、BC
21(每空2分,本题共10分)
e:氯酸钾与浓盐酸反应产生黄绿色气体 KClO3+6HCl=KCl+3Cl2↑+3H2O
a:无色溴化钾溶液渐变成黄色 2Br— + Cl2 = 2Cl— + Br2
b:无色碘化钾溶液渐呈蓝色 2I— + Cl2 = 2Cl—+ I2 I2遇淀粉溶液呈蓝色
c:氢氧化钠酚酞溶液的红色渐渐褪去 2OH—+Cl2 = Cl—+ ClO—+ H2O
d:硫酸亚铁溶液呈红色 6FeSO4+3Cl2=2Fe2(SO4)3+2FeCl3 Fe3+遇SCN-呈红色
现象1分,方程式1分
22(9分)
![]() ⑴反应产生气泡快慢或反应完成的先后或试管壁的冷热程度 (2分)
⑴反应产生气泡快慢或反应完成的先后或试管壁的冷热程度 (2分)
控制阴离子相同,排除阴离子的干扰(1分)2H2O2 2H2O+O2↑(2分)
⑵分液漏斗(1分)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位(2分) 时间(或收集一定体积的气体所需要的时间)(1分)
23(10分)(1)![]() (1分)
(1分)
(2)2NH3![]() NH
NH![]() +NH
+NH![]() (1分)
(1分)
(3)大于(1分);c(NO![]() )> c( NH
)> c( NH![]() )>c(Na+)>c(OH—)>c(H+ )(2分)
)>c(Na+)>c(OH—)>c(H+ )(2分)
(4)C (1分)
![]() (5)2NH3+NaClO N2H4+NaCl+H2O(2分)
(5)2NH3+NaClO N2H4+NaCl+H2O(2分)
![]() (6)N2H4(g)+NO2(g)
(6)N2H4(g)+NO2(g) ![]() N2(g)+2H2O(g);△H=-568KJ/mol(2分)
N2(g)+2H2O(g);△H=-568KJ/mol(2分)
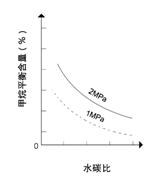 24(8分)
24(8分)
(1)K=c(COH2 (2分)
增大 (2分)
(2)< (1分)
图(右)(2分)
(3)防止催化剂中毒(1分)
25(13分)
⑶ ②酸式滴定管或移液管,(1分) ③酸式滴定管;(1分)
④甲醛吸收不充分,影响测定结果;(1分)
⑤偏高;(2分)
⑥不需要,加入最后一滴草酸溶液时溶液褪色且半分钟内不恢复紫红色(2分)
⑷ (75clVl—30c2V2) ×103;(3分) 27.60 (2分) 否 (1分)
26(10分)
(1)1:2 (2分)(2)3NF3+5H2O = 2NO+HNO3+9HF(3分),
0.4NA或2.408×1023 (2分)
(3)产生红棕色气体、产生刺激性气味气体、产生白雾(写出1个即得分,2分)
(4)NaNO3 (1分)
27(10分)
(1)c(总)= c(H3PO4)+ c(H2PO4—)+ c(HPO42—)+ c(PO43—)(2分)
(2)HPO42—+H+ = H2PO4—(1分) H2PO4—(1分)、HPO42—(1分)
(3)酸(1分) H2PO4—在溶液中的电离程度大于水解程度。(2分)
(4)>(1分),KOH抑制了PO43—的水解(1分)
28(10分)
(1)1s22s22p63s23p64s2 或[Ar] 4s2 (2分)
(2)HF; Cl— > F— > Na+ > Al3+ (2分)
(3)三,ⅢA,分子晶体,(2分)
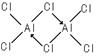
(1分)
共价键、配位键 , sp3 杂化 (2分)
(4)CaF2 (1分)