08届高三化学第一学期联考后综合训练(1)
一、选择题(每小题只有一个正确答案,每小题3分,18小题共54分)
1、氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟; B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应; D、生成1molN2有6mol电子转移
2、认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法正确的是
A.镁在空气中或纯净氧气中燃烧的产物一定只有MgO
B.钠在敞口容器中长期存放或在空气中燃烧的产物一定是Na2O2
C.一定条件下,SiO2与焦炭反应,生成的产物一定是单质硅
D.向苯酚钠溶液中通入少量CO2或过量CO2,产物一定含有NaHCO3
3、如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X
为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单
质。Z为品红溶液。实验中观察到Z褪色。则Y为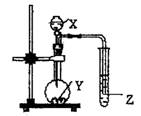
| X | |
| Y | ||
| Z | M | |
A.Na B.Mg C.Al D.Mg或Al
4、下表为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
A.非金属性:Y >Z>.M B.气态氢化物的稳定性:Y<M<Z
C.原子半径:M>Z>Y D.ZM2分子中各原子的最外层均满足8e-稳定结构
5、科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A、H2 + 2OH- -2e- =2H2O B、O2 + 4H+ + 4e- = 2H2O
C、H2 - 2e-= 2H+ D、O2 + 2H2O + 4e- = 4OH-
6、根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是 ( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点 | 810℃ | 710℃ | 190℃ | -68℃ | 2300℃ |
| 沸点 | 1465℃ | 1418℃ | 183℃ | 57℃ | 2500℃ |
A.SiCl4形成的是分子晶体 B.单质B可能是原子晶体
C.NaCl中键的强度比MgCl2的小 D.不能用电解熔化AlCl3制取单质铝
7、25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)<c(SO42-) B.2c(NH4+)=c(SO42-)
C.c(NH4+)>c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
8、经一定时间后,可逆反应aA+bB
![]() cC中物质的含量A%和C%随温度的变化曲线如
cC中物质的含量A%和C%随温度的变化曲线如
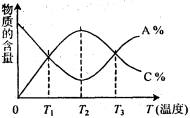 右图所示,下列说法正确的是 ( )
右图所示,下列说法正确的是 ( )
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
9、(14分)下图表示各物质之间的相互转化关系(部分反应物或生成物未列出)。其中A、D为常见金属,J为红褐色沉淀。
(1)A的原子结构示意图为_____________,B的化学式为_______________。
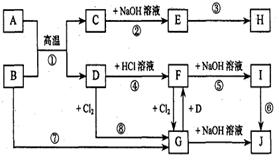 (2)反应②的离子方程式________________
(2)反应②的离子方程式________________
________________,反应⑥的化学方程式
________ ___________________。
(3)在反应③中,要使E中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物
是_______________;若将E溶于过量盐酸,反应的离子方程式为___________________。
(4)在实验室进行反应⑧时,观察到的现象是__________________________________,
在所得产物中加入水,得浑浊液,要使其变澄清,可加入少量的_____________________。
10、Ⅰ(2分)下列说法中,正确的有
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部 ②给盛有液体的体积超过三分之一的试管加热至沸腾 ③硝酸、溴水可长期盛放在棕色的滴瓶中
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤熔融氢氧化钠要在耐高温的石英坩埚中
Ⅱ(13分)某化学兴趣小组利用细废铁屑制取FeCl3•6H2O晶体。主要步骤如下:
①洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸 泡至不再产生气泡,过滤。
② 按下图组装仪器,并检查装置的气密性,将①得到的滤液放入试剂瓶B中。
③ 在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
④ 试剂瓶B中的溶液经过一系列操作,可得FeCl3•6H2O晶体。
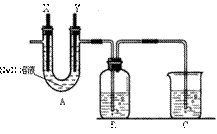 请回答下列问题:
请回答下列问题:
(1)A中的X极应连接电源的 极,A中发生
化学反应的方程式 ;
B中溶液颜色的变化 ,
反应的离子方程式是 。
(2)C烧杯中应该盛放的是 ,其作用
是 。
(3)试剂瓶B中的溶液由步骤④制得FeCl3•6H2O晶体,④需要进行的操作依次是(填序号) 。 A、加热浓缩 B、洗涤 C、过滤 D、冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是 。
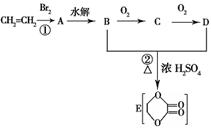 [选做题]:(10分).由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略): 请分析后回答下列问题:
[选做题]:(10分).由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略): 请分析后回答下列问题:
(1)反应的类型分别是①___________、②________________;
(2)D物质中的官能团为___________________________;
(3)C物质的结构简式___________________,物质X与A互为同分异构体,则X的结构简式为_________________,X的名称为_______________________________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式______ _______。
综合训练(1)参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | D | B | D | C | C | C | B |
9. (14分) (1) 略, Fe2O3 (每空格1分,共2分)
(2)Al2O3 + 2OH— = 2AlO2— + H2O(2分) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(2分)
(3)CO2 (2分) AlO2—+4H+=Al3++2H2O (2分)
(4)燃烧,产生棕色烟 (2分)少量盐酸 (2分)
10.(15分) Ⅰ①④ (2分)
Ⅱ 通直流电
(1)负, 2NaCl+2H2O————→Cl2↑+H2↑+2NaOH,由浅绿色变为棕黄色,
2Fe2++Cl2→2Fe3++2Cl - (1′,2′,2′,2′)
(2)NaOH溶液,吸收Cl2 (1′,1′)
(3)A D C B (2′)
(4)抑制Fe3+水解 (2′)
[选做题]:(10分)(1)①加成反应 酯化反应(或“取代反应”) (每空1分,共2分)
(2)![]() (2分)
(2分)
![]() (3)OHC—CHO H3C—CH—Br 1,1—二溴乙烷(每空1分,共3分)
(3)OHC—CHO H3C—CH—Br 1,1—二溴乙烷(每空1分,共3分)
(4)![]() (3分)
(3分)