08届高三化学第一学期联考后综合训练(10)
1.我国首个探月卫星嫦娥一号已于2007年10月24日顺利发射升空,据科学家预测,月球的土壤中吸附着数百万吨的![]() He,每百吨
He,每百吨![]() He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() He的形式存在。下列说法正确的是
He的形式存在。下列说法正确的是
A.![]() He 原子核内含有4个质子 B.
He 原子核内含有4个质子 B.![]() He 和
He 和![]() He 互为同位素
He 互为同位素
C.![]() He 原子核内含有3个中子D.
He 原子核内含有3个中子D.![]() He的最外层电子数为2,所以
He的最外层电子数为2,所以![]() He具有较强的金属性
He具有较强的金属性
2.X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4。则下列判断正确的是
A.非金属性:X<Y<Z B.气态氢化物稳定性:按X、Y、Z顺序增加
C.含氧酸的酸性:H3ZO4>H2YO4>HXO4 D.元素负化合价的绝对值:按X、Y、Z变大
3.下列物质提纯的方法能得到纯净气体的是
A.除去混在NO2中的NO:将气体与过量O2混合
B.除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.Cl2中混有HCl:将气体依次通过足量饱和NaHCO3溶液和浓硫酸
5.SO2能使浸过溴水的滤纸褪色,这说明了:
A.SO2的漂白作用 B.溴的挥发性 C.SO2的氧化性 D.溴的氧化性
6.下列各物质中,按熔点由低到高排列正确的是
A.O2、I2、Hg B.Na、K、Rb C.CO2、KCl、SiO2 D.SiC、NaCl、SO2
8.将3体积NO2气体依次通过装有能充分满足反应需要的如下物质的装置:饱和NaHCO3和Na2O2,最后用排水法所残留气体收集在集气瓶中(同温同压测定),则集气瓶中收集到的气体应是 A.1体积NO B.0.25体积O2 C.0.5体积O2 D.2体积NO2和0.5体积O2
10.下列几种情况都有白色沉淀物质生成,其中生成物的化学成分相同的是
⑴块状纯碱久置于空气中生成的白色粉末⑵盛澄清石灰水的烧杯内壁附着的白色物质
⑶生石灰久置于空气中生成的白色物质
⑷Na2SiO3水溶液置于敞口容器中,溶液中出现的白色浑浊
A.⑴、⑷ B.⑵、⑷ C.⑴、⑵ D.⑵、⑶
12.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。 ②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。 ③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有HCO3-离子
C.不能确定C1-离子是否存在 D.不能确定CO32-离子是否存在
14.14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为
A.9.6g B.6.4g C.3.2g D.1.6g
17.(7分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据上表回答下列问题:
⑴硒的熔点范围可能是 ⑵碲的主要化合价可能有
⑶非金属单质氧化性随原子序数的递变趋势_____________________。
 ⑷氧族元素的氢化物中沸点最低的是:
⑷氧族元素的氢化物中沸点最低的是:
⑸工业上Al2Te3可用来制备H2Te,完成下列化学方程式: (△H)
A12Te3 + ( ) ——A1(OH)3↓+H2Te↑
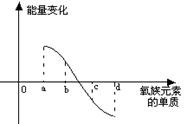
⑹右图所示为氧族元素单质与H2反应过程中的能量变化示意图,
其中a、b、c、d分别表示氧族中某一元素的单质,△H为相
同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。
则:b代表 ,d代表 (均写单质化学式)。
19.(8分)A、B、C、D、E五种物质中均含有同一种元素,它们能发生如下图所示的变化。且该元素的单质(用R表示)能与强碱溶液反应生成盐(Na2RO3)和氢气。
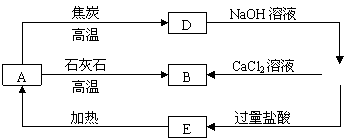 ⑴写出下列物质的化学式:
⑴写出下列物质的化学式:
C E 。
⑵写出下列反应的化学方程式:
A ® D:
A ® B:
21.(12分)氨(NH3)是重要的含
氮化合物。1774年该气体由英国
化学家普里斯特里利用熟石灰和氯化铵加热反应制成。
(1)写出实验室制取氨气的化学方程式 ;
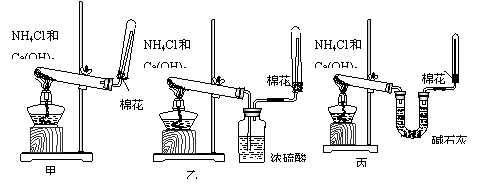 (2)为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
(2)为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
 |
实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) ;
(3)如何检验氨气是否收集满(简述操作方法、现象和结论)
;
(4)NH3的制备装置与实验室制备 气的装置相同.;
(5)如右图在圆底烧瓶里收集干燥的氨气。引发该实验的方法是,
|
综合训练(10)参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | B | D | C | B | D | C | B |
17.(7分)⑴113 ~ 450℃; (1分) ⑵-2、+4、+6; (1分)
⑶依次减弱; (1分) ⑷H2S (1分)
⑹A12Te3 + ( 6H2O)=2A1(OH)3↓ +3H2Te↑(2分) ⑺Se (1分) O2 (1分)
19.(8分)⑴C: Na2SiO3 、E:H2SiO3 或H4SiO4 。
⑵SiO2+2C![]() Si+2CO↑ CaCO3+SiO2
Si+2CO↑ CaCO3+SiO2![]() CaSiO3+CO2↑
CaSiO3+CO2↑
21.(12分) (1)2NH4Cl
+ Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O; (2)丙;
CaCl2 + 2NH3↑+ 2H2O; (2)丙;
(3)将湿润的红色石蕊试纸放在试管口,若试纸变蓝说明NH3已收满; (4)氧气;
(5)打开止水夹,挤压胶头滴管中的少量水使它进入烧瓶中。 红色溶液喷入圆底烧瓶