08届高三化学第一学期联考后综合训练(11)
1.下列有关环境问题的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
 D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
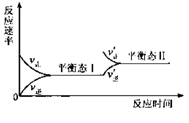
2.右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相适合的是
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,
达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一反应物在平衡态I和平衡态II时浓度不相等
3.为达到预期的实验目的,下列操作正确的是
A.欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
4.25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加人稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
5.下列离子方程式书写正确的是
A.三氯化铝溶液中加人过量氨水 Al3++3OH-===OH)3↓
B.稀硝酸中加入过量的铁粉:Fe+6H++3NO3-===Fe3++3NO2↑+3H2O
C.4mol/L的NaAlO2溶液和7mol/L的HCI等体积互相均匀混合
4AlO2-+7H++H2O===(OH)3↓+Al3+
D.盐酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
6.下列说法或表示法正确的是
A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石);ΔH = +1.19 kJ· mol—1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ· mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ· mol—1
7.在一定条件下,将3mol
A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A.x=1 B.2min内A的反应速率为0.3 mol·(L·min)-1
C.B的转化率为40% D.若混合气体的密度不变则表明该反应达到平衡状态
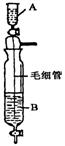
8.(6分)在Inorganic Syntheses一书中,有一装置是用以制备某种干燥的纯净气体,如下图所示:其A中应盛放一种密度比B中密度小的液体。下表中为几种液体的密度
| 溶液名称 | 浓盐酸 | 浓硫酸 | 浓氨水 | 浓氢氧化钠溶液 |
|
| 密度(g/mL) | 1.19 | 1.84 | 0.89 | 1.41 | 1.06 |
现从上述液体中选出几种适宜的试剂来利用该装置制出干燥纯净气体.
(1)制备出的气体其化学式是 。(写出全部可以制备的气体)
(2)应选用的试剂:A中盛 ;B中盛 。(任写一组)
(3)装置中毛细管的作用是 。
9.(14分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| 反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中。 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2
溶解产生Mn2+,该反应的离子方程式是 。
10.(8分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- CO32- HSO-4 |
分别取它们的水溶液进行实验。结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。据此推断它们是
A ;B ;C ;D
11.(10分)(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物AlN、AlP、AlAs等是人工合成的平等体材料,其晶体结构与单晶硅相似,As原子的电子排布式为 。在AlN晶体中,每个Al原子与 个N原子相连,与同一个Al原子相连的N原子构成的空间构型为 。在四大晶体类型中,AlN属于 晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
综合训练(11)参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | A | C | C | B | CD | BD | D |
8. (共6分)(1)HCl(2分) (2)浓盐酸;浓硫酸(各1分) (3)减缓流速(2分)
9.(14分) (1) 2Al+6H+===2Al3++3H2↑或2Al+3Cu2+===2Al3++3Cu
2Cu+O2+H2O+CO2===Cu2(OH)2CO3 (各2分)
(2)白色沉淀生成,后沉淀逐渐溶解至消失 (2分)
Al3++3OH-=== Al(OH)3↓
Al(OH)3+OH-=== AlO2-+2H2O (各2分)
|
②MnO2+H2O2+2H+=== Mn2++O2↑+2H2O (2分)
10.(8分)Na2CO3 、Al2(SO4)3、MgCl2、Ba(OH)2、NaHSO4[或Mg(HSO4)2] (各2 分)
11.(10分)(1)5(3分) (2)1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3)(2分)
4 (1分)正四面体 (1分)原子 (1分) (3)HClO 、 NH3·H2O (2分)
 浓醋酸
浓醋酸